��Ŀ����
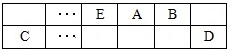
��20����30�����Eyring��Pzer����ײ���۵Ļ����������ѧ��Ӧ�Ĺ���̬���ۣ���ѧ��Ӧ������ͨ������ײ������ɵģ������ڷ�Ӧ�ﵽ������Ĺ����о���һ���������Ĺ���̬����ͼ����ʾ��NO2��CO��Ӧ����CO2��NO�����е������仯ʾ��ͼ��˵�������Ӧ�� ������ȡ����ȡ�����Ӧ��NO2��CO�������� ���������������������CO2��NO����������

��ij�¶�ʱ����һ��2 L���ܱ������У�X��Y��Z�����������ʵ�����ʱ��ı仯������ͼ����ʾ������ͼ�����ݣ�����д���пհף�
�ٸ÷�Ӧ�� minʱ�ﵽƽ��״̬����Ӧ�ȣ���
�ڸ÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��8�֣���ÿ��2�֣���1�����ȣ�������Ϊ����Ҳ�ɣ���
��2���� 2 �� ��3X+Y 2Z���������Ϊ��֣�δ��ƽ��һ�֣�2Z
2Z���������Ϊ��֣�δ��ƽ��һ�֣�2Z 3X+Y���Ե÷֣�
3X+Y���Ե÷֣�
���������������1������ͼ���֪����Ӧ������������������������������÷�Ӧ�Ƿ��ȷ�Ӧ����NO2��CO����������CO2��NO����������
��2���ٸ���ͼ���֪����Ӧ���е�2minʱ���������ʵ�Ũ�Ȳ��ٷ����仯��˵����Ӧ�ﵽƽ��״̬��
�ڸ���ͼ���֪����Ӧ��X��Y�����ʵ�����С��Z�����ʵ������࣬��X��YΪ��Ӧ�ZΪ������ҡ�n��X������n��Y������n��Z����0.3mol��0.1mol��0.2mol��3��1��2����Ӧ�Ļ�ѧ����ʽΪ��3X+Y 2Z��
2Z��
���㣺���鷴Ӧ�ȵ��й��жϡ����淴Ӧ���йؼ��㡢ͼ�����
�������������е��Ѷȵ����⣬���������ǿ�����ض�ѧ��������û���֪ʶ���ʵ�����������������������ʱע����������ʵ����ı仯���ߣ����ջ�ѧ����ʽ���жϷ�����

 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д� �ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
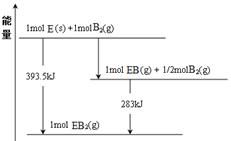
�ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д���������Ҫ�ɷ�ΪFeS2���ǹ�ҵ��ȡ�������Ҫԭ�ϣ���ȼ�ղ���ΪSO2��Fe2O3��
��1����֪1g FeS2��ȫȼ�շų�7.1kJ���������ʾFeS2��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽΪ��
______________________________________________________________��
��2����0.050molSO2(g)��0.030molO2(g)�����ݻ�Ϊ1L���ܱ������У���Ӧ��2SO2(g)��O2(g) 2SO3(g) ��һ�������´ﵽƽ�⣬���c(SO3)=0.040mol/L����������·�Ӧ��ƽ�ⳣ��K����ֵΪ___________,SO2��ƽ��ת����Ϊ__________��
2SO3(g) ��һ�������´ﵽƽ�⣬���c(SO3)=0.040mol/L����������·�Ӧ��ƽ�ⳣ��K����ֵΪ___________,SO2��ƽ��ת����Ϊ__________��
��3�����÷�Ӧ����ƽ��״̬ʱ����ʹƽ��������Ӧ�����ƶ��ҷ�Ӧ���ʼӿ죬���д�ʩ���е��� ��������ĸ��
| A����ƽ�������г���Ar | B����ƽ�������г���O2 |
| C���ı䷴Ӧ�Ĵ��� | D�����ͷ�Ӧ���¶� |
 2SO3(g) ��H<0 �� SO2��ת��������ʼ�¶�T1=673K���淴Ӧʱ�䣨t���ı仯����ͼ�������������䣬���ı���ʼ�¶�ΪT2=723K������ͼ�л����¶�T2��SO2��ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��
2SO3(g) ��H<0 �� SO2��ת��������ʼ�¶�T1=673K���淴Ӧʱ�䣨t���ı仯����ͼ�������������䣬���ı���ʼ�¶�ΪT2=723K������ͼ�л����¶�T2��SO2��ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��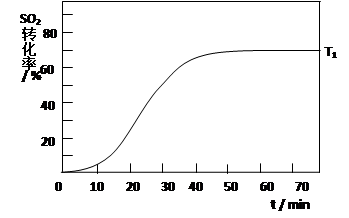
��������ȡ�봢��������Դ����������о��ȵ㡣
��1����֪��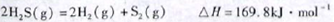
�����йظ÷�Ӧ��������ȷ����
| A������Ӧ���С��169.8kJ��mol-1 |
| B���淴Ӧ���һ��С��169.8kJ��mol-1 |
| C������Ӧ��ܲ�С��169.8kJ��mol-1 |
| D������Ӧ��ܱ��淴Ӧ���С169.8kJ��mol-1 |
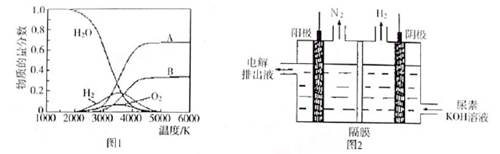
��3��H2O���ȷֽ�Ҳ�ɵõ�H2��������ˮ�ֽ���ϵ����Ҫ���������������¶ȵĹ�ϵ����ͼ1��ʾ����4000��~5000��ʱ���ܷ���������Щ��Ӧ ����д��ĸ����
��4����ȡ��������һ�ַ����ǵ������[CO��NH2��2]�ļ�����Һ��װ��ʾ��ͼ��ͼ2�������и�Ĥ����ֹ����ͨ��������������Ϊ���Ե缫�����õ��װ���е���ų�Һ�е���Ҫ�ɷ��� ��д��ѧʽ����
��5����֪�������ʵ�KSP��
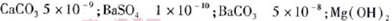
5.6��10-12��Ca��OH��2��1.4��10-5���ȼҵ�� ��ⱥ��ʳ��ˮҲ�ܵõ�������������õ���ˮ�辫�ƣ�ȥ����Ӱ���Ca2+��Mg2+��NH4+��SO42��[c��SO42����>c(Ca2+)]��ij�����������£�
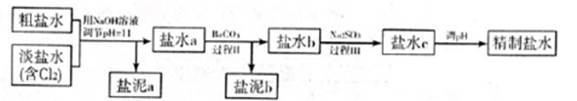
������a����ɳ�⣬�����е������� ��
�ڹ���I�н�NH4+ת��ΪN2�����ӷ���ʽ�� ��
�۹���II�г�ȥ�������� ��
�ܾ�����III������������ˮc��ʣ��Na2SO3�ĺ���С��5mg/L������ˮb��NaClO�ĺ�����7.45mg/L������10m3��ˮb����������10%Na2SO3��Һ kg����Һ����仯���Բ��ƣ�
��7�֣�(1)���������ھ�������������ˮ������������ҵ�������ΪƯ����
�ٳ������������������ҿ������������е��ʷ�Ӧ���磺
6Ag(s)+O3(g)===3Ag2O(s)����H =" -235.8" kJ/mol;
��֪��2 Ag2O(s)===4Ag(s)+O2(g)����H = +62.2kJ/mol;
��Ӧ 2O3��g��= 3O2��g�� �ġ�H = kJ/mol��
�ڿ�ѧ��P��Tatapudi��������ʹ�������������µ��ˮ�ķ����Ƶó�����������������Χ��ˮ�в�
�����������������������ɹ������⣬�����缫��ӦʽΪ �� ��2���û���̿��ԭ��������������йط�ӦΪ��C(s)+2NO(g) N2(g)+CO2(g) ij�о�С����ij�ܱյ��������(��������������䣬��������������Բ���)�м���NO�������Ļ���̿������(T1��) �����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
��2���û���̿��ԭ��������������йط�ӦΪ��C(s)+2NO(g) N2(g)+CO2(g) ij�о�С����ij�ܱյ��������(��������������䣬��������������Բ���)�м���NO�������Ļ���̿������(T1��) �����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�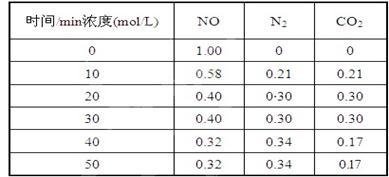
����10 min��20 min��ʱ����ڣ���CO2��ʾ�ķ�Ӧ����Ϊ ��
��д���÷�Ӧ��ƽ�ⳣ���ı���ʽK= ��
�����и�������Ϊ�жϸ÷�Ӧ�ﵽƽ��״̬���� (�������ĸ)��
| A��������ѹǿ���ֲ��� | B��2v��(NO)=v��(N2) |
| C��������CO2������������� | D�����������ܶȱ��ֲ��� |
��һ���¶��£�����NO����ʼŨ��������NO��ƽ��ת���� (����������䡱��С��)��
�����ߡ�������д���ҹ�������ҵ����ƪ�¡����������Ҫ���ܵ�ȼ�ϣ�ͨ������(N2H4)��Ϊȼ�ϣ�N2O4����������
��1����֪��N2(g) + 2O2(g) =2NO2(g) ��H����67.7 kJ��mol��1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) ��H����534.0 kJ��mol��1
2NO2(g) N2O4(g) ��H����52.7 kJ��mol��1
N2O4(g) ��H����52.7 kJ��mol��1
��д����̬������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ�� ��
��2����ҵ�Ͽ��ô�������������İ���Ӧ�Ʊ��£��÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��3��һ�������£���2L�ܱ���������ʼͶ��2 mol NH3��4 mol O2������Ӧ��
4NH3(g)+5O2(g�� 4NO(g)+6H2O(g) ��H<0
4NO(g)+6H2O(g) ��H<0
���ƽ��ʱ�������£�
| ƽ��ʱ���ʵ�����mol�� | n(NO) | n(H2O�� |
| �¶�T1 | 1.6 | 2.4 |
| �¶�T2 | 1.2 | 1.8 |
�����¶�T1�£�������10min��Ӧ�ﵽƽ�⣬��10min�ڷ�Ӧ��ƽ������
v(NH3)�� ��
���¶�T1��T2�Ĵ�С��ϵ��T1 T2���>���� ��<����������
��4�������˺���������̬ϵͳ�У�����Ҫ�����ȥ��CO2����Ҫ���ṩ�����O2��ij�ֵ绯ѧװ�ÿ�ʵ������ת����2CO2=2CO+O2��CO������ȼ�ϡ���֪�÷�Ӧ��������ӦΪ��
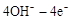 =O2��+2H2O����������ӦΪ �����������������Ʒ�Ӧ2CO=2C+O2����H��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������ ��
=O2��+2H2O����������ӦΪ �����������������Ʒ�Ӧ2CO=2C+O2����H��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������ ����5����ͼ��ij�ռ�վ����ת��ϵͳ�ľֲ�ʾ��ͼ������ȼ�ϵ�ز���KOH��ҺΪ���Һ��
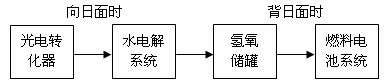
���ij��ʱ�������������й��ռ���33.6L���壨������ɱ�״��������ö�ʱ����ˮ���ϵͳ��ת�Ƶ��ӵ����ʵ���Ϊ mol��
 ��
�� ��CO�ȴ�����Ⱦ����IJ���������������Ҫ���塣
��CO�ȴ�����Ⱦ����IJ���������������Ҫ���塣 ��ʹ
��ʹ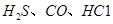 �������������ڶ����ⶨCO�ĺ�������֪��
�������������ڶ����ⶨCO�ĺ�������֪��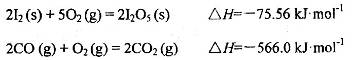
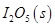 ��Ӧ����
��Ӧ����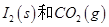 ���Ȼ�ѧ����ʽ��________________��
���Ȼ�ѧ����ʽ��________________��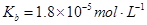

 ________2�������������������
________2�������������������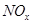 ����ǿ����Һ�����������Ρ������������£�FeSO4��Һ�ܽ�
����ǿ����Һ�����������Ρ������������£�FeSO4��Һ�ܽ�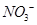 ��ԭΪNO��д���ù����в���NO��Ӧ�����ӷ���ʽ___________________________________��
��ԭΪNO��д���ù����в���NO��Ӧ�����ӷ���ʽ___________________________________��