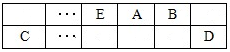
题目内容
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | N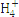 | S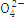 | N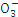 | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
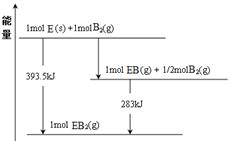
已知:H2(g)+
 O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ①
O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ①C(s)+
 O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ②
O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ②写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:
N2(g)+O2(g)
 2NO(g) ΔH>0
2NO(g) ΔH>0若1 mol空气含0.8 mol N2和0.2 mol O2,1 300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g) 2C(s)+O2(g)
已知该反应的ΔH>0,简述该设想能否实现的依据:
。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
(1)酸性 4
(2)①C(s)+ H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ/mol
②a、b
(3) ①4×10-6 温度升高,反应速率加快,平衡右移
②该反应是焓增、熵减的反应,任何温度下均不自发进行
③2CO+2NO 2CO2+N2
2CO2+N2
解析试题分析:(1)根据电荷守恒规律得c(Cl-)+ c(NO3-)+2 c(SO42-)= c(K+)+ c(Na+)+c(NH4+)+ c(H+),计算可得c(H+)=1×10-4mol/L,pH="4," PM2.5的酸碱性为酸性;
(2)①根据盖斯定律可得焦炭与水蒸气反应的热化学方程式=②-①,所以答案是C(s)+ H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ/mol;
②二氧化硫可与氢氧化钙、碳酸钠溶液反应,但不与氯化钙、亚硫酸氢钠溶液反应,所以作洗涤剂的是氢氧化钙、碳酸钠,答案选ab;
(3)①N2(g)+O2(g) 2NO(g)ΔH>0,开始时0.8 mol N2和0.2 mol O2,达到平衡, NO为8×10-4mol。根据化学方程式可计算出平衡时氮气、氧气的物质的量分别为0.7996mol、0.1996mol,NO的系数是2,所以化学平衡常数K=c(NO)2/c(N2)c(O2)=n(NO)2/n(N2)n(O2)= (8×10-4mol)2/0.7996mol×0.1996mol=4×10-6;该反应是吸热反应,温度越高,反应速率越快,对正反应有利,NO的排放量越大;
2NO(g)ΔH>0,开始时0.8 mol N2和0.2 mol O2,达到平衡, NO为8×10-4mol。根据化学方程式可计算出平衡时氮气、氧气的物质的量分别为0.7996mol、0.1996mol,NO的系数是2,所以化学平衡常数K=c(NO)2/c(N2)c(O2)=n(NO)2/n(N2)n(O2)= (8×10-4mol)2/0.7996mol×0.1996mol=4×10-6;该反应是吸热反应,温度越高,反应速率越快,对正反应有利,NO的排放量越大;
②从方程式上判断,该反应是焓增、熵减的反应,任何温度下均不自发进行;
③汽车尾气系统中装置催化转化器,目的是把有毒气体转化为无毒气体二氧化碳、氮气,所以化学方程式为2CO+2NO 2CO2+N2
2CO2+N2
考点:考查电荷守恒规律的应用,溶液pH的计算,盖斯定律的应用,化学平衡常数的计算,反应自发的判断,化学方程式的书写

 初中暑期衔接系列答案
初中暑期衔接系列答案 (1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8 kJ/mol。
己知:2 Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ/mol,则O3转化为O2的热化学方程式为 ;②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为 。
| 时间/min浓度(mol/L) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0·30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.l7 |
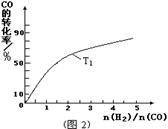
(2)用活性炭还原法处理氮氧化物,有关反应为: C(s)+2NO(g)
 N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:①10 min~20 min以内v(CO2)表示的反应速率为
②根据表中数据,计算T1℃时该反应的平衡常数K= (保留两位小数);
③下列各项能作为判断该反应达到平衡状态的是 (填序号字母);
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
(14分)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是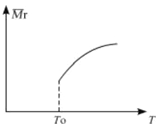
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |

假设温度为T1时向该反应容器中同时加入。(SiC14) =0.3 mol/L,c(H2) =0.3 mol/L,,c(N2) =
x mol/L, c (HCl) =0.3 mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值
范围为___
(4)该反应的原子利用率为____
(5)工业上制备SiCl4的反应过程如下:
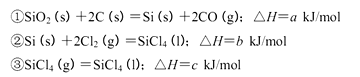
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiC14和一氧化碳的热化学方程式_____
I.工业上可用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)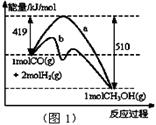
(1)“图1”表示反应中能量的变化,曲线 (填“a或b”)表示使用了催化剂;该反应的热化学方程式为 。
(2)若容器容积不变,下列措施可增大CO平衡转化率的是_____。
| A.升高温度 |
| B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 |
| D.再充入1 mol CO和2 mol H2 |
II.向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生的反应可表示为:BaSO4(s)+CO32-(aq)
 BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。(4)现有0.20 mol BaSO4,加入1.0L 2.0mol/L的饱和Na2CO3溶液处理,假设起始的c(SO42-)≈0,平衡时,K=4.0×10-2,求达到平衡时发生转化的BaSO4的物质的量。(写出计算过程,计算结果保留2位有效数字)
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知:
①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
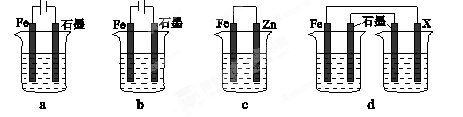
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。

 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)