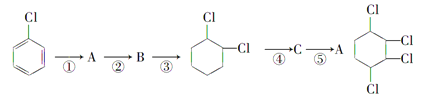
题目内容
【题目】【化学——选修2化学与技术】硫酸工业在国民经济中占有极其重要的地位。
(1)工业制硫酸时所用硫铁矿的主要成分为FeS2,其中硫元素的化合物为 。
(2)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(3)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔))。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
____________________________________________________________________。
②工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
______________________________________________________________________
_____________________________________________________________________。
(6)实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO47H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示,下列说法正确的是 。

A.炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O
B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再将溶液Y蒸发结晶即可得到绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
【答案】(1)-1;(2)硫酸铵(或硫酸钾或过磷酸钙等) ;(3)D;(4)99.75%;
(5)①SO3从吸收塔底部进入,吸收剂(浓硫酸)从顶部下淋,形成对流;
②SO2+NH3+H2O===NH4HSO3;2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑;[或SO2+2NH3+H2O===(NH4)2SO3;(NH4)2SO3+H2SO4===(NH4)2SO4+H2O+SO2↑(6)AB;
【解析】
试题分析:
(1)FeS2中铁元素是+2价,则硫元素为-1价;
(2)用硫酸制造的常见化肥有硫酸铵、硫酸氢铵、硫酸锌、硫酸钾等;
(3)硫酸生产中,第二步:SO3的制取反应原理为:2SO2+O2![]() 2SO3,该反应为可逆反应,根据化学平衡原理为了提高SO2的转化率,通常采用增大O2浓度的方法来达到使SO2尽可能多的转化为SO3的目的。A.矿石加入沸腾炉之前先粉碎,目的是为了增大黄铁矿与空气的接触面,加快4FeS2+11O2
2SO3,该反应为可逆反应,根据化学平衡原理为了提高SO2的转化率,通常采用增大O2浓度的方法来达到使SO2尽可能多的转化为SO3的目的。A.矿石加入沸腾炉之前先粉碎,目的是为了增大黄铁矿与空气的接触面,加快4FeS2+11O2![]() 2Fe2O3+8SO2 反应速率,而不是从2SO2+O2
2Fe2O3+8SO2 反应速率,而不是从2SO2+O2![]() 2SO3 反应中化学平衡角度考虑,故A不正确;B.使用V2O5作催化剂,催化2SO2+O2
2SO3 反应中化学平衡角度考虑,故A不正确;B.使用V2O5作催化剂,催化2SO2+O2![]() 2SO3 反应,只能加快该反应的速率,不能使平衡移动,故B不正确;C.接触室中催化转化器使用适宜的温度,目的是使催化剂活性最强,使反应速率最快,而实际上升高温度,会促使2SO2+O2
2SO3 反应,只能加快该反应的速率,不能使平衡移动,故B不正确;C.接触室中催化转化器使用适宜的温度,目的是使催化剂活性最强,使反应速率最快,而实际上升高温度,会促使2SO2+O2![]() 2SO3 平衡向吸热方向移动,即逆向移动,不利于提高SO2的转化率,故C不正确;D.从沸腾炉中出来的气体成分为SO2、O2、N2,经过净化后,进入接触室,炉气中要有过量的空气,即增大O2浓度,会促使2SO2+O2
2SO3 平衡向吸热方向移动,即逆向移动,不利于提高SO2的转化率,故C不正确;D.从沸腾炉中出来的气体成分为SO2、O2、N2,经过净化后,进入接触室,炉气中要有过量的空气,即增大O2浓度,会促使2SO2+O2![]() 2SO3 平衡正向移动,有利于提高SO2的转化率,故D正确;E.接触室中:2SO2+O2
2SO3 平衡正向移动,有利于提高SO2的转化率,故D正确;E.接触室中:2SO2+O2![]() 2SO3,增大压强促使平衡正向移动(即气体总体积减小的方向),减小压强促使平衡逆向移动(即气体总体积增大的方向).在常压下,不利于平衡正向移动,不利于提高SO2的转化率.对于该化学平衡,压强的增大,促使平衡正向移动,效果并不明显,所以工业上直接采用常压条件,而不采用高压条件,故E不正确;F.吸收塔中用98.3%的浓硫酸吸收SO3,主要目的是防止产生酸雾,阻碍SO3的吸收,与化学平衡移动原理无关,故F不正确;
2SO3,增大压强促使平衡正向移动(即气体总体积减小的方向),减小压强促使平衡逆向移动(即气体总体积增大的方向).在常压下,不利于平衡正向移动,不利于提高SO2的转化率.对于该化学平衡,压强的增大,促使平衡正向移动,效果并不明显,所以工业上直接采用常压条件,而不采用高压条件,故E不正确;F.吸收塔中用98.3%的浓硫酸吸收SO3,主要目的是防止产生酸雾,阻碍SO3的吸收,与化学平衡移动原理无关,故F不正确;
(4)设二氧化硫的初始浓度为a,则第一次转化掉的二氧化硫浓度为a×95%,剩余的二氧化硫浓度为a×(1-95%),进入第二次转化,则第二次转化掉的二氧化硫浓度为a×(1-95%)×95%,根据公式:转化率═转化浓度/初始浓度×100%,最终SO2的转化率═[a×95%+a×(1-95%)×95%]/a×100%═99.75%;
(5)①从接触室中出来的热气体SO2、O2、N2、SO3,在吸收塔的底部进入,从下向上运动,从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换,故答案为:从接触室中出来的热气体SO2、O2、N2、SO3,在吸收塔的底部进入,从下向上运动;从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换;②工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理,先用氨水吸收时,发生反应:SO2+2NH3H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O,以达到消除污染、废物利用的目的;
(6)分析流程可知炉渣加入硫酸溶液同时通入氧气得到固体W为氧化还原反应生成的硫单质和SiO2等,溶液X为含有Fe3+离子的溶液,调节溶液PH得到溶液Z加热得到聚铁,溶液X中加入铁反应生成硫酸亚铁溶液Y,蒸发结晶得到硫酸亚铁晶体。A、炉渣中FeS与硫酸和氧气反应生成硫单质硫酸铁和水,反应的离子方程式为4FeS+3O2+12H+═4Fe3++4S↓+6H2O,故A正确;B、炉渣加入硫酸溶液同时通入氧气得到固体W为氧化还原反应生成的硫单质和SiO2等,固体W灼烧得到气体为二氧化硫,故B正确;C、溶液X中加入过量铁粉,铁和硫酸铁溶液反应生成硫酸亚铁,通过蒸发浓缩,冷却结晶,过滤析出得到绿矾,符合晶体析出步骤,故C错误;D、用pH试纸测定方法为:将试纸放在表面皿上,用洁净的玻璃棒蘸取待测液,点在试纸的中央,然后与标准比色卡对比.氢氧化铁的含量比硫酸亚铁高,若溶液Z的pH偏小,则聚铁中生成的氢氧根的含量减少,使铁的含量减少,故D错误;选AB。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
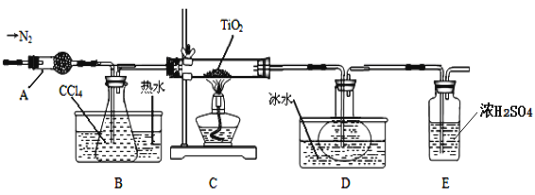
小学能力测试卷系列答案【题目】TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | —23 | 76 | 与TiCl4互溶 |
TiCl4 | —25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)仪器A的名称是 。
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃
酒精灯⑥停止通N2⑦停止加热。正确的操作顺序是__________________________。实验结束后欲分离D中的液态混合物,所采用操作的名称是 。
(3)装置E能否 (填“能”或“不能”)换成装置A,理由是 。
(4)TiCl4是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素。 。
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
(5)写出生成TiO2·xH2O的化学方程式 。
(6)检验沉淀是否洗涤干净的方法是___________________________________________。
(7) 一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取上述TiO2试样0.2g,消耗0.1 mol·L-1 NH4Fe(SO4)2标准溶液20mL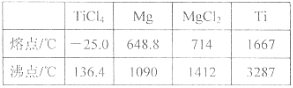 。
。
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是: 。
②该滴定操作所用到的指示剂是 。
③则TiO2质量分数为 。