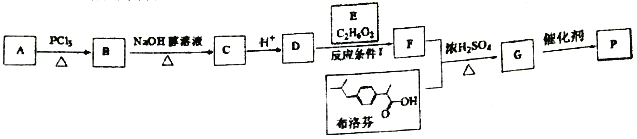
题目内容
【题目】[物质结构与性质]
已知碳元素能形成多种金属碳化物,如碳化钙,俗称为电石。
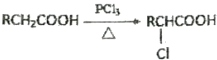
(1)电石(CaC2)是用CaO与焦炭在电炉中加强热反应生成的,写出此反应的化学方程式 ,CaC2中含有化学键的类型为 ,C22-与N2互为等电子体,C22-的电子式可表示为 ,其中σ键和π键数目之比为 。
(2)已知MgO、CaO的熔点分别为2852℃、2614℃,分析熔点差异的原因是 。
(3)苯丙氨酸是一种重要的氨基酸,其结构如图所示,分子中第一电离能最大的原子价电子排布式是 ,其中碳原子的杂化方式有 。
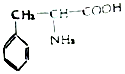
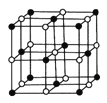
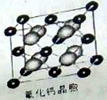
(4)已知CaF2晶体(如图,Ca2+处于面心)的密度为ρg/cm3,NA为阿伏加德常数,相邻的两个Ca2+的核间距为a cm,则CaF2的摩尔质量(M)可以表示为 g/mol。
【答案】(1)CaO+3C![]() CaC2+CO↑;离子键和共价键;
CaC2+CO↑;离子键和共价键;![]() ;1:2
;1:2
(2)MgO、CaO均属于离子晶体,离子晶体的熔点取决于晶格能的大小,因镁离子半径比钙离子半径小,故晶格能MgO大于CaO,所以MgO的熔点大于CaO。(3)2s22p3;sp2和sp3;(4)a3ρNA
【解析】
试题分析:
(1)电石制备化学方程式为:CaO+3C![]() CaC2+CO↑;CaC2中含有离子键和共价键;根据等电子原理可知C22-的电子式为
CaC2+CO↑;CaC2中含有离子键和共价键;根据等电子原理可知C22-的电子式为![]() ,其中σ键和π键数目之比为1:2。
,其中σ键和π键数目之比为1:2。
(2)MgO、CaO均属于离子晶体,离子晶体的熔点取决于晶格能的大小,因镁离子半径比钙离子半径小,故晶格能MgO大于CaO,所以MgO的熔点大于CaO。
(3)苯丙氨酸分子中含有C、H、O、N四种元素,分子中第一电离能最大的原子是N,其价电子排布式为2s22p3;分子中碳原子有双键碳和单键碳,故杂化方式为sp2和sp3;
(4)该立方体中钙离子位于顶点,数目为:8×+6×=4,氟离子位于体内,数目为8,则晶胞摩尔质量为4M,两个Ca2+的核间距为acm,晶胞边长为acm,ρ(a)3=,M=a3ρNA。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案