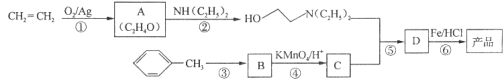
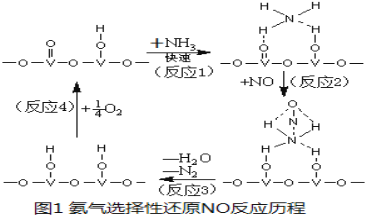
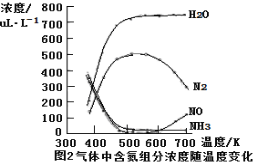
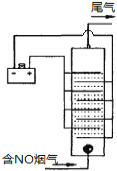
��Ŀ����
����Ŀ������ѧ����ѡ��3���ʽṹ�����ʡ�
ԭ�������������������Ԫ��A��B��C��D���δ��ڵ�һ���������ڣ���Ȼ���д��ڶ���A�Ļ����Bԭ�Ӻ��������6�ֲ�ͬ���˶�״̬��B��C���γ����������η��ӣ�D�Ļ�̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӡ�
��ش��������⣺
��1��������Ԫ���е縺������Ԫ�أ����̬ԭ�ӵļ۵����Ų�ͼΪ ��
��2��C�������������Ԫ�طֱ���A�γɵĻ�����е��ɸߵ��͵�˳���� ���ѧʽ����������˵ݱ���ɵ�ԭ���� ��
��3��BԪ�ؿ��γɶ��ֵ��ʣ�һ�־���ṹ��ͼһ��ʾ����ԭ�ӵ��ӻ�����Ϊ ����һ�ֵľ�����ͼ����ʾ�������ʽ��ʾ�þ����Ŀռ������� ��
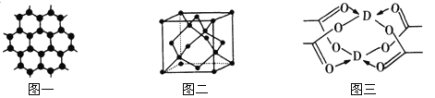
��4��DԪ���γɵĵ��ʣ��侧����Dԭ�ӵ���λ��Ϊ ��D�Ĵ����ξ���ֲ��ṹ��ͼ�����þ����к��еĻ�ѧ���� (��ѡ�����)��
�ټ��Լ� �ڷǼ��Լ� ����λ�� �ܽ�����
��5��DԪ���γɵĵ��ʣ��Ȳ����ڰ�ˮҲ������˫��ˮ�����������ߵĻ����Һ��д���÷�Ӧ�����ӷ���ʽ ��
���𰸡���1��![]()
��2��HF��HI��HBr��HCl HF����֮���γ������ʹ��е�ϸߣ�HCl��HBr��HI���Ӽ��Է��Ӽ���������ϣ���Է�������Խ���»���Խ�е�Խ�ߡ�
��3��sp2 ![]()
��4��12 �� �٢ڢ�
��5��Cu+4NH3��H2O+ H2O2��[Cu(NH3)4]2++2OH-+4 H2O
��������
���������ԭ�������������������Ԫ��A��B��C��D�ֱ��ڵ�һ���������ڣ���Ȼ���д��ڶ���A�Ļ������AΪ��Ԫ�أ�Bԭ�Ӻ��������6�ֲ�ͬ���˶�״̬����������6�����ӣ�BΪ̼Ԫ�أ�D�Ļ�̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӣ�Dԭ����Χ�����Ų�Ϊ3d104s1����DΪͭԪ�أ����ԭ��������֪��Cֻ�ܴ��ڵ������ڣ�B��C���γ����������ͷ��ӣ���BΪ��Ԫ�ء�
��1������Ԫ���е縺��������Cl�����̬ԭ�ӵļ۵�����Ϊ7����̬ԭ�ӵļ۵����Ų�ͼΪ![]()
��2��HF����֮���γ������ʹ��е�ϸߣ�HCl��HBr��HI���Ӽ��Է��Ӽ���������ϣ���Է�������Խ���»���Խ�е�Խ�ߣ����е��ɸߵ��͵�˳����HF��HI��HBr��HCl��
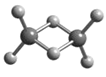
��3��ͼһΪƽ��ṹ�������״�ṹ��̼̼������Ϊ120�㣬ÿ��̼ԭ�Ӷ������3��̼ԭ�ӣ�̼ԭ�Ӳ�ȡsp2�ӻ������ݾ�����ʾ��ͼ��֪��������ÿ��Cԭ������Χ4��Cԭ���γ���������ṹ����̼ԭ�Ӱ뾶Ϊr�������ı߳�Ϊa��![]() =2r��r=
=2r��r=![]() ��������̼ԭ�ӵĸ���Ϊ8��1/8+6��1/2+4=8����̼ԭ�ӵ����Ϊ
��������̼ԭ�ӵĸ���Ϊ8��1/8+6��1/2+4=8����̼ԭ�ӵ����Ϊ![]() r3��8�����������Ϊa3����þ����Ŀռ�������
r3��8�����������Ϊa3����þ����Ŀռ�������![]() ��
��![]() ��3��a3��100%=
��3��a3��100%=![]() ��
��
��4������CuΪ�����������ܶѻ��������侧����Cuԭ�ӵ���λ��Ϊ12�����ͼ������ͭ����ľֲ��ṹ��ȷ���侧���к��м��Լ����Ǽ��Լ�����λ������ѡ�٢ڢۡ�
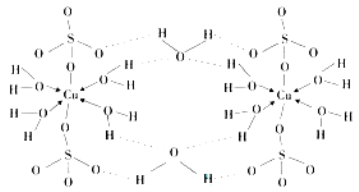
��5��Cu2���пչ����NH3���й¶Ե��ӣ�Cu2������NH3����λ����ϳɻ����ͭ���ʼȲ����ڰ�ˮҲ������˫��ˮ�����������ߵĻ����Һ����÷�Ӧ�����ӷ���ʽΪCu+4NH3��H2O+ H2O2��[Cu(NH3)4]2++2OH-+4 H2O��

 ��У����ϵ�д�
��У����ϵ�д�