题目内容
【题目】TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
Ⅰ.制备TiCl4
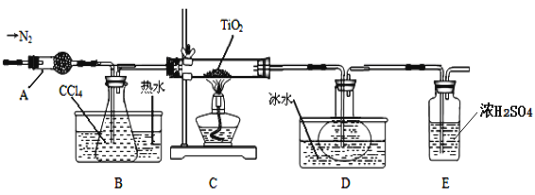
实验室利用反应TiO2 (s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | —23 | 76 | 与TiCl4互溶 |
TiCl4 | —25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)仪器A的名称是 。
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃
酒精灯⑥停止通N2⑦停止加热。正确的操作顺序是__________________________。实验结束后欲分离D中的液态混合物,所采用操作的名称是 。
(3)装置E能否 (填“能”或“不能”)换成装置A,理由是 。
(4)TiCl4是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素。 。
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
(5)写出生成TiO2·xH2O的化学方程式 。
(6)检验沉淀是否洗涤干净的方法是___________________________________________。
(7) 一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取上述TiO2试样0.2g,消耗0.1 mol·L-1 NH4Fe(SO4)2标准溶液20mL 。
。
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是: 。
②该滴定操作所用到的指示剂是 。
③则TiO2质量分数为 。
【答案】(1)干燥管(1分) (2)②①④③⑤⑦⑥(1分) 蒸馏 (或分馏) (1分)
(3)不能 (1分) 装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行 (1分)
(4)取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si。 (2分)(其他合理答案也可给分)
(5)TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl (2分)
TiO2·xH2O↓+4HCl (2分)
(6)取最后一次洗涤液于试管中加入硝酸酸化的AgNO3若没有产生沉淀,则已洗干净。(1分)
(7)①抑制NH4Fe(SO4)2水解 (1分) ②KSCN溶液 (1分) ③80﹪(2分)
【解析】
试题分析:通过氮气将装置中空气排出,防止TiCl4被氧化,A为干燥管,干燥氮气,防止生成的TiCl4遇潮湿的气体产生白雾;B装置加热使四氯化碳挥发,C中装置在加热条件下,发生反应TiO2(s)+CCl4(g)![]() TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,D装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,E装置连接空气,盛放浓硫酸,干燥空气。
TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,D装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,E装置连接空气,盛放浓硫酸,干燥空气。
(1)仪器A呈球形,在该实验中用于干燥氮气,为干燥管;
(2)反应得到气体TiCl4与二氧化碳,装置气密性要好,在加装药品之前应检验装置的气密性,因此根据以上分析可知正确的操作顺序为②①④③⑤⑦⑥;CCl4、TiCl熔点较低,D装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏 (或分馏)方法分离;
(3)由于TiCl4遇潮湿空气产生白雾,发生水解反应,且反应在无氧条件下进行,故E装置作用是防止空气中水蒸气、氧气进入;A装置可以吸收水,但不能吸收空气中的氧气,不能保证反应在无氧环境下进,故E装置不能换成A装置;
(4)钛是一种耐强酸强碱的金属,而硅能溶于碱生成硅酸盐,取少量合金样品于试管中,滴加过量NaOH溶液,振荡,Si+2NaOH+H2O=Na2SiO3+2H2↑,静置后取上层清液,再逐滴滴入稀盐酸至过量,Na2SiO3+2HCl=H2SiO3↓+2NaCl,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si;
(5)TiCl4水解生成TiO2xH2O,设TiCl4的系数为1,根据元素守恒,TiO2xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(x+2),所以化学方程式为TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl;
TiO2·xH2O↓+4HCl;
(6)沉淀表面有吸附的氯离子,则判断沉淀是否洗涤干净的操作是取最后一次洗涤液于试管中加入硝酸酸化的AgNO3,若没有产生沉淀,则已洗干净。
(7)①铁离子易水解,配制溶液时先加一些硫酸,使溶液呈酸性,抑制抑制NH4Fe(SO4)2水解;
②因为KSCN作指示剂时,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3,所以用KSCN作指示剂;
③根据氧化还原反应中得失电子相等得二者的关系式,TiO2~NH4Fe(SO4)2,二氧化钛的质量=0.1mol/L×0.02L×80g/mol=0.16g,TiO2试样0.2g,其质量分数=![]() ×100%=80%。
×100%=80%。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案