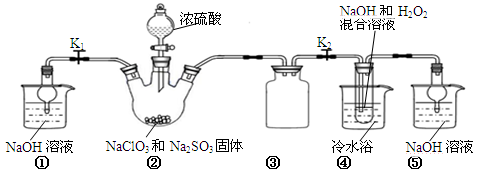
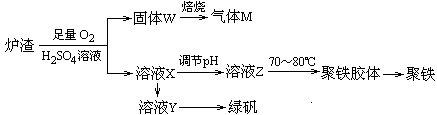
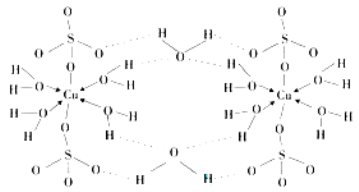
题目内容
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。
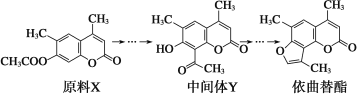
下列说法不正确的是( )
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去、氧化、还原反应
D.1 mol依曲替酯能与2 mol NaOH发生反应
【答案】C
【解析】
试题分析:A.原料X与中间体Y的分子式相同,结构不同,所以二者互为同分异构体,故A正确;B.原料X中含C=C,则能使酸性KMnO4溶液褪色,故B正确;C.中间体Y中含C=C、C=O可发生加成反应,含-COOC-、酚-OH可发生取代反应,但不能发生消去反应,故C错误;D.依曲替酯中-COOC-及水解生成的酚-OH均与NaOH反应,则1mol依曲替酯只能与2molNaOH发生反应,故D正确;

练习册系列答案
相关题目