题目内容
【题目】[化学—选修3:物质结构与性质]
(1)下列有关微粒间作用力的说法正确的是
A.配位键的强度有大有小,所以有的配合物很稳定,有的很不稳定
B.水加热到很高的温度都难以分解是因为水分子间存在氢键
C.壁虎能在光滑的墙壁上行走是因为壁虎脚底的细毛与物体表面的分子产生分子间作用力
D.互为手性异构本的分子具有完全相同的组成和原子排列,所以生产手性药物时无需分离手性异构体
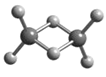
(2)判断下列哪个模型代表金属晶体锌的堆积方式 。

(3)第四周期未成对电子数最多的P区元素的元素符号是 ,核外电子占据
个原子轨道。
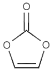
(4)碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图。碳原子的杂化方式有 ,分子中σ键与π键之比为 。
(5)比较NH2-和NH3的键角∠HNH的大小:NH2- NH3(填“﹥”“=”“﹤”),请用价层电子对互斥规解释: 。
(6)SO32-中硫原子的价层电子对互斥模型是 ;写出一种与SO32-互为等电子体的分子 。
(7)SiC晶胞与金刚石晶胞相似,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 。
【答案】(1)A、C(2)乙(3)As,18(4)sp2 4:1
(5)﹤NH2-中N原子孤电子对数为2,NH3中N原子孤电子对数为1,孤电子与成键电子间的斥力大于成键电子与成键电子间的斥力,孤对电子数前者多,排斥作用强,所以前者键角小
(6)四面体,PCl3(或NF3,NCl3合理即可)(7)![]()
【解析】
试题分析:
(1)A.配位键仍属于共价键,故其强度有大有小,形成的配合物有的很稳定,有的很不稳定,正确;B.水加热到很高的温度都难以分解是因为H-O共价键键能较大,所以较稳定,水分子间存在氢键只影响物理性质,错误;C.壁虎能在光滑的墙壁上行走是因为壁虎脚底的细毛与物体表面的分子产生分子间作用力,正确;D.互为手性异构本的分子具有完全相同的组成和原子排列,但化学性质有差异,故生产手性药物时需分离手性异构体,错误。
(2)金属晶体锌为六方最密堆积方式;
(3)第四周期未成对电子数最多的P区元素为As,核外有电子的轨道为1s、2s、2p、3s、3p、3d、4s、4p,占据18个原子轨道。
(4)碳酸亚乙烯酯分子中全部为双键碳,故杂化方式为sp2,分子中有σ键8个,π键2个,故σ键与π键之比为4:1;
(5)NH2-中N原子孤电子对数为2,NH3中N原子孤电子对数为1,孤电子与成键电子间的斥力大于成键电子与成键电子间的斥力,孤对电子数前者多,排斥作用强,所以前者键角小;
(6)SO32-中中心原子价电子对数为4对,故硫原子的价层电子对互斥模型是四面体;等电子体是原子个数相同,价电子数相同的物质的互称,与SO32-互为的分子有PCl3,NF3,NCl3等等。
(7)根据均摊法可得晶胞中碳原子数为8×+6×=4,硅原子数为4。晶胞边长为a cm,可得晶胞体积为a3,碳原子直径为b cm,则晶胞中碳原子总体积为×π×()3×4,硅原子直径为c cm,则晶胞中碳原子总体积为×π×()3×4,该晶胞的空间利用率为![]() 。
。