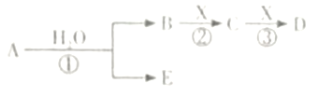
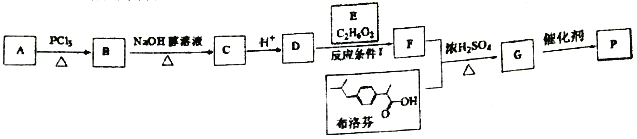
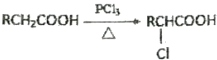
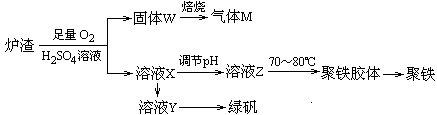
��Ŀ����
����Ŀ����ѧ������������������������أ������йصĻ�ѧ����֪ʶ���Ը������ǵ����
��I���ճ�������ʹ�õĸ��ֵ�ؾ������û�ѧ��Ӧ����ѧ��ת��Ϊ���ܣ����ָ����ĵ�صķ�չ�ǻ�ѧ�������һ���ش��ס���ش������йػ�ѧ��Դ�����⣺
��1�������йص�ص���������ȷ����___________��
A��п�̸ɵ�ع���һ��ʱ���̼����ϸ B������ȼ�ϵ�ؿɽ�����ֱ��ת��Ϊ����
C������ȼ�ϵ�ع���ʱ�����ڸ��������� D��̫���ܵ�ص���Ҫ�����Ǹߴ��ȵĶ�������
��2��пͭԭ���װ����ͼ��ʾ�����������ӽ���Ĥֻ���������Ӻ�ˮ����ͨ���������й�������ȷ������ ��

A��ͭ�缫�Ϸ���������Ӧ
B����ع���һ��ʱ��׳ص�c(SO42-)��С
C����ع���һ��ʱ����ҳ���Һ������������
D���׳��е����������ҳ��ƶ���������Һ�е��ƽ��
��II������ˮ����������ˮʱ����Ҫ�õ���ˮ������ˮ��������ɱ��������
��3���������(K2FeO4)��һ�����Ͷ��ˮ����������ҵ���ж��ַ����Ʊ�������أ�����һ�ַ�����������������Һ���ô����������������������÷�Ӧ�Ŀ������ӷ���ʽ��ʾΪ___________��
��4���ø�����غ�п�Ƴɵĸ������Ե�أ��ܴ������ͨ���Ե�ض�50%�ĵ��ܣ���֪�õ�ص��ܷ�ӦΪ2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2�����ĵ缫��Ӧ��______________��
���𰸡���1��C��
��2��CD��
��3��2Fe(OH)3+3ClO- +4OH- =2FeO42-+3Cl-+5H2O��
��4��3Zn��6e-+10OH- =Zn��+2ZnO2����-+5H2O��
��������
���������I��1��A��п�̸ɵ����̼��Ϊ���������Ե�ع���һ��ʱ���̼���������䣬����B������ȼ�ϵ�ؿɽ���ѧ��ת��Ϊ���ܣ�����C������ȼ�ϵ�ع���ʱ�����ڸ���ʧȥ���ӣ�����������ȷ��D��̫���ܵ�ص���Ҫ�����Ǹߴ��ȵĹ裬������2����Cu��Znԭ����У�������ԣ�Zn>Cu������Zn�Ǹ�����Cu��������A������ͭ�缫�Ϸ�����ԭ��Ӧ������B����ع���һ��ʱ��׳���Zn2+Ũ���������Ը���ͬ�ֵ����ų⣬���ֵ���������ԭ����Һ��SO42-�����ƶ����ʼ׳ص�c(SO42-)������C����ع���һ��ʱ����ҳ���Cu2+���Ϸŵ磬����Cu�����ڵ缫�ϸ��š����ڽ���Ĥ��������Ĥ��������Һ�е�Zn2+����뵽�ҳأ�����Zn��Cu����ת�Ƽ�Ħ��������֪��Һ�����������ӣ���ȷ��D���ҳ���Cu2+�ŵ磬�׳��еIJ��ϲ���Zn2+��Ϊʹ��Һ�ʵ����ԣ���׳ص����������ҳ��ƶ����Ӷ�������Һ�е��ƽ�⣬��ȷ����II����3���������(K2FeO4)��һ�����Ͷ��ˮ����������ҵ���ж��ַ����Ʊ�������أ�����һ�ַ�����������������Һ���ô������������������������ݵ����غ㼰����غ㡢ԭ���غ㣬�ɵø÷�Ӧ�����ӷ���ʽΪ2Fe(OH)3+3ClO- +4OH- =2FeO42-+3Cl-+5H2O����4���ø�����غ�п�Ƴɵĸ������Ե�أ��ܴ������ͨ���Ե�ض�50%�ĵ��ܣ���֪�õ�ص��ܷ�ӦΪ2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2�������ܷ�Ӧ����ʽ��֪ZnԪ�ػ��ϼ����ߣ�ʧȥ���ӣ�����������Ӧ��Zn�������������ܷ�Ӧʽ��֪�������ĵ缫��Ӧ��3Zn��6e-+10OH- =Zn��+2ZnO2����-+5H2O��