题目内容
3.高温、催化剂条件下,某反应达到平衡,平衡常数K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法正确的是( )| A. | 该反应的焓变为负值 | |
| B. | 2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常数K1=K2 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 | |
| D. | 若恒容、恒温下充入CO,则K值变大 |
分析 衡常数指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数k=$\frac{c(CO)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c(H{\;}_{2})}$,所以该反应化学方程式应为CO2+H2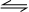 CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.
CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.
解答 解:A、恒容时,温度升高,H2浓度减小,则该反应为吸热反应,所以△H>0,故A错误;
B、由平衡常数可知,该反应为CO2+H2 CO+H2O,所以2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常数K1=K2,故B正确;
CO+H2O,所以2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常数K1=K2,故B正确;
C、升高温度,正、逆反应速率都增大,正反应速率增大更多,平衡正向移动,故C错误;
D、平衡常数仅与温度有关,所以恒容、恒温下充入CO,则K值不变,故D错误.
故选B.
点评 本题考查化学平衡常数、影响化学平衡的因素等,难度中等,注意对化学平衡常数的理解,同一反应化学计量数不同平衡常数不同.

练习册系列答案
相关题目
5.下列关于12C和13C微粒的说法中正确的是( )
| A. | 它们是同种元素 | B. | 它们的化学性质不同 | ||
| C. | 它们是同位素关系 | D. | 它们是同种原子 |
14.在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
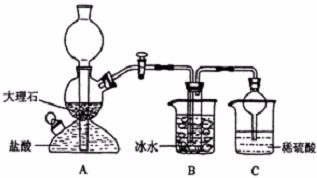
(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
参照表中数据,请分析B装置中使用冰水是因为温度越低,碳酸氢钠的溶解度越小,便于析出.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液 的洗气装置,其作用是除去CO2中混合的HCl气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.

(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液 的洗气装置,其作用是除去CO2中混合的HCl气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.
11.下列有关化学用语表示正确的是( )
| A. | HClO的结构式:H-O-Cl | |
| B. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| C. | CH2F2的电子式: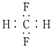 | |
| D. | Cl-的结构示意图: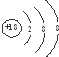 |
18.在蒸发皿中蒸发液体,下列操作不正确的是( )
| A. | 直接用酒精灯的外焰加热蒸发皿 | |
| B. | 加热过程中不断用玻璃棒搅拌 | |
| C. | 加热到液体全部消失 | |
| D. | 蒸发皿中出现多量晶体、少量液体时,停止加热,利用蒸发皿的余热烘干 |
15.某溶液中可能有Fe3+、Mg2+、Na+、Ba2+、I-、Cl-、OH-、SO42-中的若干种,下列说法中正确的是( )
| A. | 溶液中最多有4种离子 | B. | 若溶液有颜色,则一定没有OH-、I- | ||
| C. | 若溶液呈碱性,则一定含有Na+ | D. | 该溶液不可能溶解单质铜 |
12.关于强、弱电解质的叙述不正确的是( )
| A. | 强电解质在溶液中完全电离,其水溶液中不存在分子 | |
| B. | 同一弱电解质溶液,温度不同时,导电能力不同 | |
| C. | 强电解质溶液导电能力不一定比弱电解质溶液的导电能力强 | |
| D. | 强电解质在液态时不一定会导电,但在固态时一定不导电 |