题目内容
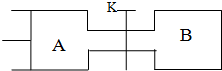
14.在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和: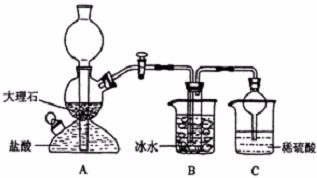
(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液 的洗气装置,其作用是除去CO2中混合的HCl气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.
分析 (1)A装置是指取二氧化碳气体的装置,是碳酸钙和盐酸发生反应生成氯化钙、水和二氧化碳;C装置稀硫酸是尾气处理装置吸收过量的氨气;
(2)B装置中的试管内是溶有氨和氯化钠的饱和溶液,通入二氧化碳气体会发生反应生成碳酸氢钠和氯化铵,温度越低越有利于碳酸氢钠的晶体析出;
(3)通入二氧化碳没有得到碳酸氢钠晶体,是二氧化碳气体中含有氯化氢气体,通入后和氨气反应不能生成碳酸氢钠,所以需要加一个洗气装置用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体;
(4)依据化学方程式计算理论生成碳酸氢钠的质量,结合实际生成的碳酸氢钠的质量计算产率.
解答 解:(1)A装置是指取二氧化碳气体的装置,是碳酸钙和盐酸发生反应生成氯化钙、水和二氧化碳;反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O;C装置稀硫酸是尾气处理装置吸收过量的氨气,防止污染环境;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;吸收从B装置中的试管内逸出的氨气,减少对环境的污染;
(2)B装置中的试管内是溶有氨和氯化钠的饱和溶液,通入二氧化碳气体会发生反应生成碳酸氢钠和氯化铵,依据图标分析可知温度越低,碳酸氢钠的溶解度越小,所以温度越低越有利于碳酸氢钠的晶体析出;
故答案为:温度越低碳酸氢钠溶解度越小,便于析出;
(3)二氧化碳气体中含有氯化氢气体,通入后和氨气反应不能生成碳酸氢钠,所以的不到碳酸氢钠晶体,所以需要加一个洗气装置用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体;
故答案为:AB,饱和碳酸氢钠溶液;除去二氧化碳气体中的氯化氢气体;
(4)饱和食盐水中含NaCl的质量为5.85g,依据化学方程式计算NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3(晶体),理论得到碳酸氢钠质量为8.4g:实验后得到干燥的NaHCO3晶体的质量为5.04g,则碳酸氢钠的产率=$\frac{5.04g}{8.4g}$×100%=60%;
故答案为:60%.
点评 本题考查了侯氏制碱的反应原理和实验设计和操作,产率计算方法,流程中注意问题的分析是解题关键,题目难度中等.

| A. | 用托盘天平准确称量干燥的NaCl固体2.925 g | |
| B. | 准确称量2.9 g NaCl固体溶于500 mL蒸馏水 | |
| C. | 在500 mL 容量瓶中溶解氯化钠固体,然后加蒸馏水至刻度线 | |
| D. | 正确称量2.9 g混有KCl的NaCl固体,其他操作均正确,配好后的溶液中c(Cl-)偏低 |
发生反应:CH3CH2CH2CH2OH+HBr→CH3CH2CH2CH2Br+H2O.还会有烯、醚等副产物生成.反应结束后将反应混合物蒸馏,分离得到1-溴丁烷,已知相关有机物的性质如下:
| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
(2)制备操作中,加入的浓硫酸和溴化钠的作用是二者反应生成HBr.
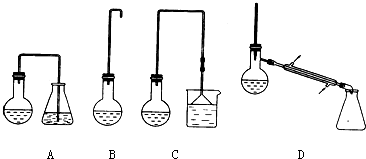
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是D(填序号);该操作应控制的温度(t)范围是101.6℃≤t<117.25℃.
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl.
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4(难溶于水)为催化剂,可以将CO2和CH4直接氧化成乙酸.
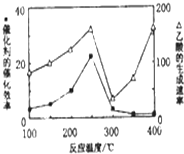
①不同温度下催化剂的催化效率与乙酸的生成速率如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度等.(答一条即可)
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3 Cu2Al2O4+32 H++2 NO3-=6 Cu2++6 Al3++2 NO↑+16 H2O.
| A. | OH-+H+═H2O | B. | OH-+CO32-+2H+═HCO3-+H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
| A. | 该反应的焓变为负值 | |
| B. | 2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常数K1=K2 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 | |
| D. | 若恒容、恒温下充入CO,则K值变大 |
| A. | 氯金酸钠中金元素的化合价为+3 | |
| B. | 葡萄糖具有还原性 | |
| C. | 检测时,NaAuCl4发生氧化反应 | |
| D. | 纳米金单质颗粒分散在水中所得的分散系能产生丁达尔效应 |