题目内容
8.短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱.E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成.E被足量氢氧化钠溶液吸收得到无色溶液F.溶液F在空气中长期放置发生反应,生成物之一为H.H与过氧化钠的结构和化学性质相似,其溶液显黄色.请回答下列问题:
(1)单质A是一种黄色固体,组成单质A的元素在周期表中的位置是第三周期VIA族.用物理方法洗去试管内壁的A,应选择的试剂是二硫化碳;化学方法洗去试管内壁的A利用的是其与热浓的氢氧化钠溶液发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,请写出化学方法洗去试管内壁的A时发生的化学反应方程式3S+6NaOH(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2Na2S+Na2SO3+3H2O.
(2)工业上获得B时常使用电解法,请写出阳极反应的电极反应方程式2O2--4e-=O2↑.
(3)FeCl3溶液中的Fe3+可以催化G与氧气在溶液中的反应,此催化过程分两步进行,请写出Fe3+参与的第一步反应的离子反应方程式2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(4)工业上吸收E常用氨水,先生成正盐,最终产物为酸式盐.写出E与该正盐反应的化学方程式H2S+(NH4)2S=2NH4HS.
(5)将D溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,则加入氢氧化钡溶液的过程中的现象是产生白色沉淀,白色沉淀逐渐增多,后白色沉淀逐渐减少,最终仍以白色沉淀存在.
(6)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.该反应的氧化产物为Na2SO4,当生成2mol二氧化氯时,转移电子2mol.
(7)H的溶液与稀硫酸反应的化学方程式Na2S2+H2SO4=Na2SO4+H2S↑+S↓.
分析 短周期元素形成的常见非金属固体单质A与常见金属单质B,且单质A是一种黄色固体,A与B在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱,则A为S,B为Al,C为Al2S3,D为Al(OH)3,E为H2S,E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成,而G为SO2.E被足量氢氧化钠溶液吸收得到无色溶液F为Na2S,溶液F在空气中长期放置发生反应,生成物之一为H,H与过氧化钠的结构和化学性质相似,其溶液显黄色,可以推测H为Na2S2.
解答 解:短周期元素形成的常见非金属固体单质A与常见金属单质B,且单质A是一种黄色固体,A与B在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱,则A为S,B为Al,C为Al2S3,D为Al(OH)3,E为H2S,E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成,而G为SO2.E被足量氢氧化钠溶液吸收得到无色溶液F为Na2S,溶液F在空气中长期放置发生反应,生成物之一为H,H与过氧化钠的结构和化学性质相似,其溶液显黄色,可以推测H为Na2S2.
(1)组成单质A的元素为硫元素,在周期表中的位置是:第三周期VIA族,用物理方法洗去试管内壁的硫,应选择的试剂是二硫化碳;化学方法洗去试管内壁的硫利用的是其与热浓的氢氧化钠溶液发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,反应生成硫化钠、亚硫酸与水,反应方程式为:3S+6NaOH(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2Na2S+Na2SO3+3H2O,
故答案为:第三周期VIA族;二硫化碳;3S+6NaOH(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2Na2S+Na2SO3+3H2O;
(2)工业电解熔融氧化铝冶炼Al,阳极发生氧化反应,电极反应方程式:2O2--4e-=O2↑,
故答案为:2O2--4e-=O2↑;
(3)FeCl3溶液中的Fe3+可以催化SO2与氧气在溶液中的反应,此催化过程分两步进行,Fe3+参与的第一步反应的离子反应方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(4)工业上吸收H2S常用氨水,先生成正盐,最终产物为酸式盐,H2S与该正盐反应的化学方程式:H2S+(NH4)2S=2NH4HS,
故答案为:H2S+(NH4)2S=2NH4HS;
(5)将Al(OH)3溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,开始产生硫酸钡与氢氧化铝沉淀,而氢氧化铝会溶解,则加入氢氧化钡溶液的过程中的现象是:产生白色沉淀,白色沉淀逐渐增多,后白色沉淀逐渐减少,最终仍以白色沉淀存在,
故答案为:产生白色沉淀,白色沉淀逐渐增多,后白色沉淀逐渐减少,最终仍以白色沉淀存在;
(6)SO2与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯,SO2为还原剂,被氧化为SO42-,及氧化产物为,根据电子得失可以判断生成2mol二氧化氯时,转移电子2mol,
故答案为:Na2SO4;2;
(7)由Na2S2与过氧化钠的结构和化学性质相似,Na2S2的溶液与稀硫酸反应的化学方程式:Na2S2+H2SO4=Na2SO4+H2S↑+S↓,
故答案为:Na2S2+H2SO4=Na2SO4+H2S↑+S↓.
点评 本题考查无机物推断,涉及硫元素单质化合物性质,是对学生综合能力的考查,(7)为易错点、难点,中学不涉及,注意根据过氧化钠性质进行迁移解答,难度中等.

| A. | 标准状况下,1molH2O的体积约为22.4L | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2 NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 标准状况下,2.24 LCl2做成的氯水中含有0.1NA个Cl2分子 |
| A. | 该反应的焓变为负值 | |
| B. | 2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常数K1=K2 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 | |
| D. | 若恒容、恒温下充入CO,则K值变大 |
 (该类结构简式为键线式,又如:CH3CH=CHCH2Cl的键线式可写为
(该类结构简式为键线式,又如:CH3CH=CHCH2Cl的键线式可写为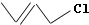 ).根据你所学知识判断,合成碳纤维R的单体最有可能的是( )
).根据你所学知识判断,合成碳纤维R的单体最有可能的是( )| A. | CH2=CH2和N2 | B. | CH3-C≡C-NH2 | C. | HC≡C-C≡N | D. | CH2=CH-CH=NH |
| A. | K+、Na+、MnO${\;}_{4}^{-}$、Cl- | B. | K+、Ag+、NO${\;}_{3}^{-}$、Cl- | ||
| C. | Ba2+、Na+、Cl-、SO${\;}_{4}^{2-}$ | D. | Na+、Cu2+、NO${\;}_{3}^{-}$、Cl- |
| A. | 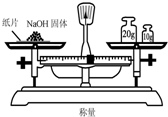 称量氢氧化钠固体的质量 称量氢氧化钠固体的质量 | |
| B. |  分离沸点相差较大的互溶液体混合物 分离沸点相差较大的互溶液体混合物 | |
| C. | 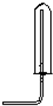 用排气法收集氯气 用排气法收集氯气 | |
| D. | 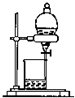 分离互不相溶的两种液体 分离互不相溶的两种液体 |
