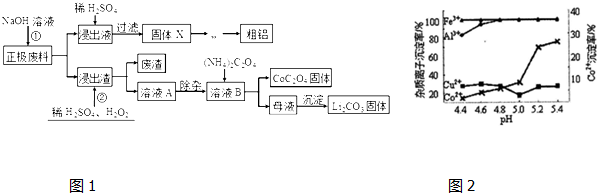
题目内容
16. 氮、硫、氯及其化合物是中学化学重要的组成部分.
氮、硫、氯及其化合物是中学化学重要的组成部分.(1)氨气燃料电池使用的电解质溶液是KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O.该电池负极的电极反应式为2NH3+6OH--6e-=N2+6H2O;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是bd.
a.电能全部转化为化学能
b.SO42-的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个
(2)①将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:所得悬浊液$\stackrel{操作①}{→}$白色沉淀$\stackrel{加试剂A}{→}$观察现象并判断则试剂A的化学式为HCl.实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是2SO2+2Ba2++O2+2H2O═2BaSO4↓+4H+.
②利用如图所示电化学装置吸收工业尾气中SO2,阴极上生成Cu.写出装置中阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.
(3)已知KSP( BaSO4)=1.0×10-10,KSP( BaCO3)=2.5×10-9.某同学设想用下列流程得到BaCl2,
BaSO4$→_{①}^{饱和Na_{2}CO_{3}溶液}$BaSO3$→_{②}^{盐酸}$BaCl2.则①的离子方程式为BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq),该反应的平衡常数K=0.04.
分析 (1)依据化学方程式分析氨气化合价变化,判断发生氧化反应的物质是氨气,原电池中在负极失电子,正极上氧气得到电子生成氢氧根离子;用氨燃料电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液为CuSO4溶液,阳极上Cu以及比铜活泼的金属放电,阴极上铜离子放电;
(2)①(2)实现固体和液体的分离可以采用过滤的方法;硫酸钡和盐酸不反应,但是亚硫酸钡可以和盐酸反应;
②电解池中吸收工业尾气中SO2,阴极上生成Cu,阳极是二氧化硫失电子发生氧化反应生成硫酸根离子;
(3)硫酸钡中加入饱和碳酸钠溶液,发生沉淀转化生成碳酸钡沉淀,依据化学反应的离子方程式书写平衡常数,结合钡离子浓度相同得到平衡常数的计算式为溶度积常数比值,代入数值计算.
解答 解:(1)电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+6OH--6e-=N2+6H2O,
用氨燃料电池电解CuSO4溶液,阳极上氢氧根离子放电,阴极上铜离子放电而析出铜,阳极上电极反应式为:4OH--4e-=O2↑+2H2O,
a、电解池中是电能转化为化学能,但不可能完全转化,故错误;
b、硫酸根离子不参与反应,所以浓度不变,故正确;
c、电解池中阳离子移向阴极,故错误;
d、阳极上Cu以及比铜活泼的金属放电,Ag、Pt、Au等金属留在阳极泥里,故正确;
e、阳极上Cu以及比铜活泼的金属放电,所以若阳极质量减少64g,则转移电子数不是2NA个,故错误;
故答案为:2NH3+6OH--6e-=N2+6H2O;bd;
(2)①将SO2通入到BaCl2溶液中,出现的白色浑浊可能是硫酸钡还可能是亚硫酸钡,硫酸钡和盐酸不反应,但是亚硫酸钡可以和盐酸反应,溶解,可以用盐酸来鉴别沉淀成分,故答案为:HCl;2SO2+2Ba2++O2+2H2O═2BaSO4↓+4H+;
②电解池中吸收工业尾气中SO2,阴极上生成Cu,阳极是二氧化硫失电子发生氧化反应生成硫酸根离子,电极反应为:SO2+2H2O-2e-=4H++SO42-;
故答案为:SO2+2H2O-2e-=4H++SO42-;
(3)硫酸钡中加入饱和碳酸钠溶液,发生沉淀转化生成碳酸钡沉淀,反应的离子方程式为:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq),则平衡常数=$\frac{c(S{O}_{{4}^{2-}})}{c(C{O}_{{3}^{2-}})}$=$\frac{c(S{{O}_{4}}^{2-})•c(B{a}^{2+})}{c(C{{O}_{3}}^{2-})•c(B{a}^{2+})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1×1{0}^{-10}}{2.5×1{0}^{-9}}$=0.04;
故答案为:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq);0.04.
点评 本题主要考查了氧化还原反应、离子方程式式的书写以及化学计算,题目难度中等,注意沉淀转化关系的分析判断,电解池原理应用,掌握基础是关键.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案①使煤充分燃烧,提高煤能的利用率
②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气
④减少CO2的产生,避免“温室效应”
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
| A. | 0.44 s | B. | 2 s | C. | 0.33 s | D. | 1 s |
| A. | 该晶体中一定含有SCN- | |
| B. | Fe3+的氧化性比Br2的氧化性强 | |
| C. | Fe2+被Br2氧化为Fe3+ | |
| D. | Fe2+ 与SCN-不能形成血红色的化合物 |
| A. | 加热金属铝使之融化 | B. | 液氨受热蒸发 | ||
| C. | 加热碘化氢气体使之分解 | D. | 加热硅晶体使之融化 |
| A. | 将SO2分别通入BaCl2、Ba(NO3)2溶液中,都会观察到有白色沉淀生成 | |
| B. | 检验某酸性溶液中Cl-、SO42-,选用试剂及顺序是过量的AgNO3溶液、Ba(NO3)2溶液 | |
| C. | 纯锌与稀硫酸反应产生氢气的速率较慢,加入少量硫酸铜固体后,反应速率会加快 | |
| D. | 对于任意化学平衡,只要增大反应物浓度,都会使反应物转化率增大 |
| A. | 电池的电解液可为LiCl水溶液 | |
| B. | 该电池放电时,负极发生还原反应 | |
| C. | 放电时正极反应式为:2SOCl2+4e-=4Cl-+S+SO2 | |
| D. | 放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
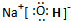 .
.