题目内容
6.将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是( )①使煤充分燃烧,提高煤能的利用率
②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气
④减少CO2的产生,避免“温室效应”
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
分析 将煤块粉碎,增大与空气的接触面积,能煤充分燃烧,提高煤能的利用率,并减少CO的产生,经脱硫处理可减少SO2的产生,避免造成“酸雨”.
解答 解:①将煤块粉碎,增大与空气的接触面积,能煤充分燃烧,提高煤能的利用率,故①正确;
②煤中含有S元素,燃烧时能生成SO2,经脱硫处理可减少SO2的产生,避免造成“酸雨”,故②正确;
③在适当过量的空气中燃烧,生成CO2,减少CO的产生,故③正确;
④无论是否脱硫处理,在适当过量的空气中燃烧,生成CO2的量都不变,不能减少CO2的产生,故④错误.
所以正确的是①②③.
故选D.
点评 本题考查常见生活污染及治理,题目难度不大,注意题中“将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧”等信息.

练习册系列答案
相关题目
17.如图是某化学兴趣小组制备PCl3的实验装置(部分仪器已省略):

有关物质的部分性质如下:
请回答下列问题:
(1)仪器戊的名称为冷凝管.
(2)实验时甲中所发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)乙中盛放的试剂是饱和氯化钠溶液,其作用是除去氯气中的氯化氢;丙中盛放的试剂是浓硫酸,其作用是除去氯气中的水蒸气.
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(5)碱石灰的作用是吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入影响产品纯度(答出一条即可).
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为3PCl5+2P$\frac{\underline{\;\;△\;\;}}{\;}$5PCl3,后通过蒸馏(填实验操作名称),即可得到PCl3纯品.

有关物质的部分性质如下:
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(1)仪器戊的名称为冷凝管.
(2)实验时甲中所发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)乙中盛放的试剂是饱和氯化钠溶液,其作用是除去氯气中的氯化氢;丙中盛放的试剂是浓硫酸,其作用是除去氯气中的水蒸气.
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(5)碱石灰的作用是吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入影响产品纯度(答出一条即可).
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为3PCl5+2P$\frac{\underline{\;\;△\;\;}}{\;}$5PCl3,后通过蒸馏(填实验操作名称),即可得到PCl3纯品.
14.表示对应化学反应的离子方程式正确的是( )
| A. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O | |
| B. | 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+13H+═4Cr3++11H2O+3CH3COO- | |
| C. | 用惰性电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ |
1.下列烃中,一卤代物的同分异构体的数目最少和最多的分别是( )
| A. | 乙烷 | B. | 2-甲基丙烷 | C. | 2,2-二甲基丙烷 | D. | 2,2-二甲基丁烷 |
11.高纯度镍是许多有机反应的催化剂.某化学课题组拟以电镀废液(含有NiSO4、CuSO4和FeSO4)为原料,设计提取高纯镍的简单工艺如图1所示(阴离子省略):

(1)加入新制氯水所发生反应的离子方程式为Cl2+2Fe2+═2Fe3++2Cl-
(2)加入NiCO3的目的是调节溶液pH=3.7,使溶液中的 Fe3+完全变成Fe(OH)3沉淀而除去
(3)在实验室中灼烧所使用的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳
(4)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥.
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍.
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全等角度评价两种方案的优点.
方案1:操作简便、节省原料、实验安全.
方案2:产品纯度较高.
(5)方案2所用的氢气可以选用如图2装置中的BD来制取(填写字母,下同),收集氢气可选用装置FH.
(6)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的d.装置D中导管a的作用是平衡分液漏斗和烧瓶中的气压,便于分液漏斗中液体顺利流下.
a.CO2 b.Cl2 c.NO d.SO2.

| 难溶电解质 | NiS | CuS | Cu(OH)2 | Ni(OH)2 | Fe(OH)3 |
| Ksp或沉淀完全的pH | 1.1×10-21 | 1.3×10-36 | pH=9 | pH=9.5 | pH=3.7 |
(2)加入NiCO3的目的是调节溶液pH=3.7,使溶液中的 Fe3+完全变成Fe(OH)3沉淀而除去
(3)在实验室中灼烧所使用的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳
(4)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥.
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍.
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全等角度评价两种方案的优点.
方案1:操作简便、节省原料、实验安全.
方案2:产品纯度较高.
(5)方案2所用的氢气可以选用如图2装置中的BD来制取(填写字母,下同),收集氢气可选用装置FH.
(6)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的d.装置D中导管a的作用是平衡分液漏斗和烧瓶中的气压,便于分液漏斗中液体顺利流下.
a.CO2 b.Cl2 c.NO d.SO2.
18.美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118、质量数为293的新元素,该元素原子核内的中子数为( )
| A. | 47 | B. | 57 | C. | 61 | D. | 175 |
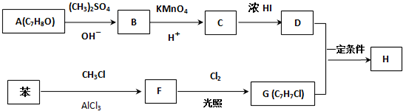

 .
. .
. .
. .
.

 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI. ,与过量的酸性KMnO4溶液作用,得到下列三种化合物:
,与过量的酸性KMnO4溶液作用,得到下列三种化合物: 、
、 和
和 .化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )
.化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )



 氮、硫、氯及其化合物是中学化学重要的组成部分.
氮、硫、氯及其化合物是中学化学重要的组成部分.