题目内容
1.下列说法正确的是( )| A. | 将SO2分别通入BaCl2、Ba(NO3)2溶液中,都会观察到有白色沉淀生成 | |
| B. | 检验某酸性溶液中Cl-、SO42-,选用试剂及顺序是过量的AgNO3溶液、Ba(NO3)2溶液 | |
| C. | 纯锌与稀硫酸反应产生氢气的速率较慢,加入少量硫酸铜固体后,反应速率会加快 | |
| D. | 对于任意化学平衡,只要增大反应物浓度,都会使反应物转化率增大 |
分析 A.SO2对应的酸比HCl弱,与BaCl2不反应;
B.Cl-、SO42-与过量的AgNO3溶液都生成沉淀;
C.锌和铜在酸性条件下形成原电池反应,反应速率较大;
D.增大某一反应物的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低.
解答 解:A.SO2对应的酸比HCl弱,与BaCl2不反应,没有沉淀产生,故A错误;
B.Cl-、SO42-与过量的AgNO3溶液都生成沉淀,而只有SO42-与Ba(NO3)2溶液生成硫酸钡沉淀,所以检验某酸性溶液中Cl-、SO42-,选用试剂及顺序是过量的Ba(NO3)2溶液、AgNO3溶液,故B错误;
C.加入少量CuSO4固体,置换出铜,锌和铜在酸性条件下形成原电池反应,反应速率较大,故C正确;
D.增大某一反应物的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低,故D错误.
故选C.
点评 本题考查元素化合物知识,题目难度中等,本题注意SO2对应的酸比HCl弱以及原电池反应等知识,为元素化合物中常考查知识,学习中注意积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.高纯度镍是许多有机反应的催化剂.某化学课题组拟以电镀废液(含有NiSO4、CuSO4和FeSO4)为原料,设计提取高纯镍的简单工艺如图1所示(阴离子省略):
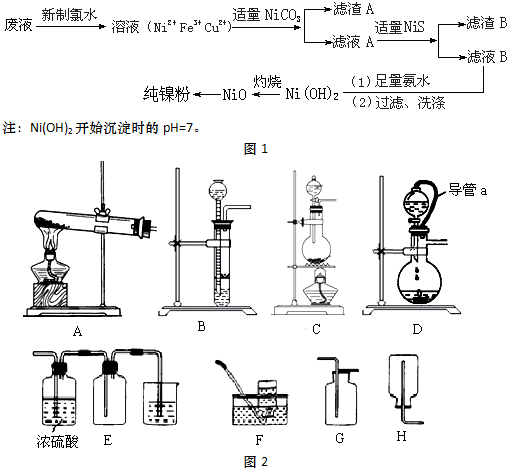
(1)加入新制氯水所发生反应的离子方程式为Cl2+2Fe2+═2Fe3++2Cl-
(2)加入NiCO3的目的是调节溶液pH=3.7,使溶液中的 Fe3+完全变成Fe(OH)3沉淀而除去
(3)在实验室中灼烧所使用的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳
(4)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥.
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍.
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全等角度评价两种方案的优点.
方案1:操作简便、节省原料、实验安全.
方案2:产品纯度较高.
(5)方案2所用的氢气可以选用如图2装置中的BD来制取(填写字母,下同),收集氢气可选用装置FH.
(6)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的d.装置D中导管a的作用是平衡分液漏斗和烧瓶中的气压,便于分液漏斗中液体顺利流下.
a.CO2 b.Cl2 c.NO d.SO2.

| 难溶电解质 | NiS | CuS | Cu(OH)2 | Ni(OH)2 | Fe(OH)3 |
| Ksp或沉淀完全的pH | 1.1×10-21 | 1.3×10-36 | pH=9 | pH=9.5 | pH=3.7 |
(2)加入NiCO3的目的是调节溶液pH=3.7,使溶液中的 Fe3+完全变成Fe(OH)3沉淀而除去
(3)在实验室中灼烧所使用的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳
(4)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥.
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍.
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全等角度评价两种方案的优点.
方案1:操作简便、节省原料、实验安全.
方案2:产品纯度较高.
(5)方案2所用的氢气可以选用如图2装置中的BD来制取(填写字母,下同),收集氢气可选用装置FH.
(6)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的d.装置D中导管a的作用是平衡分液漏斗和烧瓶中的气压,便于分液漏斗中液体顺利流下.
a.CO2 b.Cl2 c.NO d.SO2.
12.下列说法不正确的是( )
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 从硫酸亚铁铵溶液中获取硫酸亚铁铵晶体,可以用蒸发结晶,也可以用冷却结晶 | |
| C. | iPhone6外壳易掉色是因为铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| D. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 |
9.以下说法正确的是( )
| A. | C60与金刚石一样属于原子晶体 | |
| B. | 干冰升华破坏了共价键 | |
| C. | 共价化合物中一定不含离子键 | |
| D. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 |
6.随着人们生活质量的不断提高,废电器必须进行集中处理的问题被提到议事日程,其首要原因是( )
| A. | 利用电器中的金属材料 | B. | 防止电器造成污染 | ||
| C. | 废电器经过处理后还可以重新使用 | D. | 回收其中非金属材料 |
13.一种由甲醇(CH3OH)和氧气以及氢氧化钠做电解质溶液的新型电池,关于此电池的推断正确的是( )
| A. | 通入氧气的一极是负极 | |
| B. | 放电时,溶液中的OH-向正极移动 | |
| C. | 反应中若有6mol电子发生转移,则有32g CH3OH被还原 | |
| D. | 该电池工作时甲醇一极附近溶液的pH降低 |
10.已知某“瘦肉精”中含有克伦特罗,其结构如图,下列有关克伦特罗的叙述不正确的是( )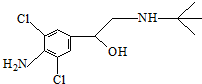

| A. | 该物质在一定条件下可发生消去反应和酯化反应 | |
| B. | 该物质分子中含有6个饱和碳原子 | |
| C. | 1 mol该物质与足量NaOH溶液反应,最多需NaOH 2 mol | |
| D. | 该物质的分子式为C12H18ON2Cl2 |
11.下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
| A. | C3H6、C2H4 | B. | C2H6、C2H6O | C. | C2H4、C2H6O | D. | C3H4、C2H6O |
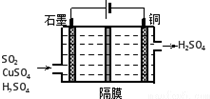 氮、硫、氯及其化合物是中学化学重要的组成部分.
氮、硫、氯及其化合物是中学化学重要的组成部分.