题目内容
KMnO4是一种重要的氧化剂。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是 。
a.硝酸 b.硫酸 c.盐酸
②将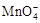 氧化C2O42?的离子方程式补充完整:
氧化C2O42?的离子方程式补充完整:
□MnO4? +□C2O42?+□ ==□Mn2+ +□CO2↑+□ 。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
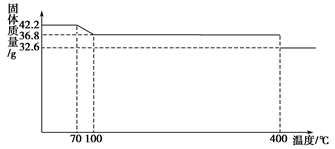
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60 s |
| 褪色后,再滴入第2滴 | 15 s |
| 褪色后,再滴入第3滴 | 3 s |
| 褪色后,再滴入第4滴 | 1 s |
请分析KMnO4溶液褪色时间变化的可能原因 。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为 。
(1)①b ②2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
(2)①容量瓶、胶头滴管;
②反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好;③0.02mol/L
解析试题分析:(1)①在酸性条件下,高锰酸钾与NO3-、Cl-能发生氧化还原反应,不与SO42-反应,故b正确;②根据缺项配平法,方程式左边氧原子个数多于右边氧原子的个数,左边方格内加氢,右边方格内加H2O,根据得失电子守恒可知:高锰酸钾中的锰离子由+7价降为+2价,共得到5mol电子,草酸钠中碳元素的化合价由+3价升为+4价,共失去2mol电子,要使得失电子守恒,消耗的草酸钠与高锰酸钾的物质的量之比应为5:2,即化学方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
(2)①对于未知仪器的选择最好的办法就是要按照化学实验的步骤去核对,才不会疏漏,配置一定物质的量浓度的溶液需要容量瓶、胶头滴管;②反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好,故答案为:反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好。
③KMnO4溶液的体积取三次测量的平均值为: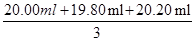 =20.00ml,设高锰酸钾溶液的浓度为c
=20.00ml,设高锰酸钾溶液的浓度为c
2MnO4-+5C2O42- +16H+=2Mn2+ +10CO2↑+8H2O
2mol 5mol
c×(20×10-3) L (25×10-3)L× 0.0400 mol·L-1
所以2mol:5mol= c×(20×10-3) :(25×10-3) × 0.0400
解得c=0.02mol/L 故答案为:0.02mol/L.
考点:探究物质的组成或测量物质的含量、氧化还原反应、中和滴定。本题属于实验探究和数据处理的题目。

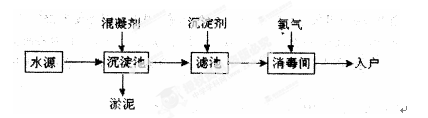
某兴趣小组在课外活动中对某溶液进行了多次的检测,其中的三次检测结果如下表所示,请回答下列问题:
| | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2CO3、NaCl |
| 第三次 | KCl、K2CO3、Na2SO4、NaCl |
(1)三次检测结果中,第 次的结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在SO42-、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 |
| 第一步 | 向溶液中滴加过量的硝酸 | 检验 ① 的存在 | ② |
| 第二步 | 继续滴加过量的 ③ 溶液 | 检验SO42-的存在 | ④ |
| 第三步 | 过滤,再向滤液中滴加 ⑤ 溶液 | 检验 ⑥ 的存在 | Ag++Cl- = AgCl↓ |
(3)在上述实验的第一步中,能否将硝酸改为稀盐酸? (填“能”或“不能”,如果填“能”,则不用说理由;如果填“不能”,则说明理由)。
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1
则CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g);△H= ;
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= (小数点后保留3位);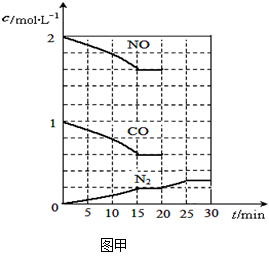
①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
(填字母);
| A.加入催化剂 | B.降低温度 | C.缩小容器体积 | D.增加CO2的量 |