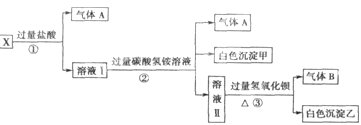
题目内容
有一固体混合物,可能由Na2CO3、Na2SO4、FeSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
① 将固体混合物溶于水中,搅拌后得无色透明溶液;
② 往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③ 过滤,将沉淀物置于足量稀硝酸中,发现沉淀部分溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是 ,一定不含有的物质是 ,(均填化学式)。对可能含有的物质,可采用向滤液中滴加 溶液的方法来检验。
(2)写出步骤③中的离子方程式 。
(1)Na2CO3、Na2SO4;FeSO4、CaCl2 ;HNO3酸化的AgNO3溶液。(2)BaCO3+2H+=Ba2++CO2↑+H2O
解析试题分析:对给定的物质进行分析: CaCl2与Na2CO3、Na2SO4会反应产生沉淀,而不能共存;FeSO4水溶液是浅绿色的根据①确定无FeSO4 ,由②知可能含Na2CO3、Na2SO4中的至少一种,确定无CaCl2。由③知Na2CO3、Na2SO4二者都有.因为BaSO4不溶于水也不溶于酸,而BaCO3不溶于水却能溶于酸;实验与NaCl无关,NaCl可能有也可能没有。可利用AgCl既不溶于水也不溶于酸,用HNO3酸化的AgNO3溶液来确定该物质的存在。
考点:考查物质的溶解性、离子反应、离子共存、离子方程式考查等知识。

KMnO4是一种重要的氧化剂。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是 。
a.硝酸 b.硫酸 c.盐酸
②将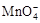 氧化C2O42?的离子方程式补充完整:
氧化C2O42?的离子方程式补充完整:
□MnO4? +□C2O42?+□ ==□Mn2+ +□CO2↑+□ 。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60 s |
| 褪色后,再滴入第2滴 | 15 s |
| 褪色后,再滴入第3滴 | 3 s |
| 褪色后,再滴入第4滴 | 1 s |
请分析KMnO4溶液褪色时间变化的可能原因 。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为 。
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定
不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol·L-1 | | | | |

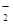 、MnO
、MnO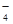 、CO
、CO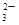 、SO
、SO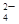 中的若干种离子组成,取溶液进行右图实验:
中的若干种离子组成,取溶液进行右图实验: