题目内容
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1
则CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g);△H= ;
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= (小数点后保留3位);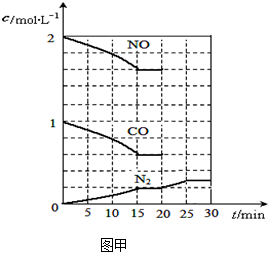
①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
(填字母);
| A.加入催化剂 | B.降低温度 | C.缩小容器体积 | D.增加CO2的量 |
(1)△H=-867 kJ·mol–1 (3分)
(2)K=0.035(或带单位:L/mol)(3分);向右、不移动; B(各2分)
(3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(3分)
解析试题分析:(1) ①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H=" –574" kJ·mol–1;
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H=" –" 1160 kJ·mol–1;
依据盖斯定律计算①+ ②得到:CH4(g) + 2NO2(g) = N2(g) + CO2(g) + 2H2O(g) △H=" –867" kJ·mol–1;
故答案为:△H= –867 kJ·mol–1;
(2)依据图象分析,15min时达到平衡时N2浓度为0.2mol·L–1,NO平衡浓度为1.6mol·L–1,CO浓度为0.6 mol·L–1,CO2浓度为0.4 mol·L–1,反应2NO(g) + 2CO(g)  N2(g) + 2CO2(g)的平衡常数
N2(g) + 2CO2(g)的平衡常数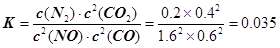 。故答案为:0.035。①若保持温度不变,20min时再向容器中充入CO气体0.6mol,此时c(CO) =" 1.2" mol·L–1,而生成物浓度不变,根据平衡移动原理,平衡将正反应方向移动。②若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)="1.6" mol·L–1,c(CO)="0.6" mol·L–1 + 0.6 mol·L–1 =" 1.2" mol·L–1,c(N2) =" 0.2" mol·L–1 + 0.6 mol·L–1 =" 0.8" mol·L–1,c(CO2) =" 0.4" mol·L–1;
。故答案为:0.035。①若保持温度不变,20min时再向容器中充入CO气体0.6mol,此时c(CO) =" 1.2" mol·L–1,而生成物浓度不变,根据平衡移动原理,平衡将正反应方向移动。②若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)="1.6" mol·L–1,c(CO)="0.6" mol·L–1 + 0.6 mol·L–1 =" 1.2" mol·L–1,c(N2) =" 0.2" mol·L–1 + 0.6 mol·L–1 =" 0.8" mol·L–1,c(CO2) =" 0.4" mol·L–1;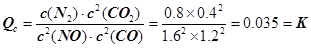 ,平衡不动。③如图甲所示,20min时,改变反应条件,导致反应速率减小,氮气浓度增大,平衡正向移动。加入催化剂,平衡不移动,A不合题;反应是气体体积减小的放热反应,降温可使平衡正向移动,氮气浓度增大,B符合题意;缩小容器体积虽然可使平衡正向移动,但改变条件的瞬间,N2浓度增大,与图中描绘的情况不符,C不合题意;增加CO2的量,平衡逆向移动,N2浓度减小,D也不合题。故答案为:B。
,平衡不动。③如图甲所示,20min时,改变反应条件,导致反应速率减小,氮气浓度增大,平衡正向移动。加入催化剂,平衡不移动,A不合题;反应是气体体积减小的放热反应,降温可使平衡正向移动,氮气浓度增大,B符合题意;缩小容器体积虽然可使平衡正向移动,但改变条件的瞬间,N2浓度增大,与图中描绘的情况不符,C不合题意;增加CO2的量,平衡逆向移动,N2浓度减小,D也不合题。故答案为:B。
(3) 总反应的离子方程式为:2SO2+O2+2H2O=4H+ + 2SO42-,总反应减去反应4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O即得另一离子方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
考点:本题考查热化学方程式和盖斯定律的计算应用,化学平衡影响因素分析,平衡常数的计算方法,平衡移动原理的应用,离子方程式的书写。

 中考解读考点精练系列答案
中考解读考点精练系列答案KMnO4是一种重要的氧化剂。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是 。
a.硝酸 b.硫酸 c.盐酸
②将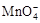 氧化C2O42?的离子方程式补充完整:
氧化C2O42?的离子方程式补充完整:
□MnO4? +□C2O42?+□ ==□Mn2+ +□CO2↑+□ 。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60 s |
| 褪色后,再滴入第2滴 | 15 s |
| 褪色后,再滴入第3滴 | 3 s |
| 褪色后,再滴入第4滴 | 1 s |
请分析KMnO4溶液褪色时间变化的可能原因 。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为 。
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定
不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol·L-1 | | | | |
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。