题目内容
9.一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质物质的量之比为3:8,则参加反应的Cl2与NaOH物质的量之比为( )| A. | 8:11 | B. | 3:5 | C. | 1:2 | D. | 18:8 |
分析 根据次氯酸钠、氯酸钠和氯化钠的化学式确定氯原子和钠离子的关系,再根据原子守恒确定氯气和氢氧化钠的物质的量关系.
解答 解:NaClO、NaClO3、NaCl的化学式中,氯原子和钠离子的个数比都是1:1,再根据钠盐中氯原子和氯气分子中氯原子守恒及氢氧化钠和钠盐中钠离子守恒得,氯气的物质的量是钠盐的$\frac{1}{2}$,氢氧化钠的物质的量等于钠盐的物质的量,所以参加反应的Cl2与NaOH物质的量之比=1:2,
故选C.
点评 本题以氧化还原反应为载体考查了物质的量的有关计算,难度较大,明确化学式中各微粒的关系及原子守恒来解答即可.

练习册系列答案
相关题目
19.铜镁合金1.52g完全溶解于50mL密度为1.40g•mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况).向反应后的溶液中加入1.0mol•L-1 NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 该合金中铜与镁的物质的量之比是2:1 | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
20.下列各组变化中,后者一定包括前者的是( )
| A. | 物理变化、化学变化 | B. | 氧化还原反应、分复反应 | ||
| C. | 氧化还原反应、化合反应 | D. | 分解反应、复分解反应 |
17.向盛有100mL 0.5mol•L-1的硫酸溶液中加入25mL 0.8mol•L-1的氯化钡溶液,过滤后,向滤液中滴加氢氧化钠溶液中和其酸性,需2.5mol•L-1的氢氧化钠溶液( )
| A. | 100mL | B. | 40mL | C. | 25mL | D. | 20mL |
1.能正确表示下列反应的离子方程式是( )
| A. | NaCN水溶液显碱性:CN-+H2O?HCN+OH- | |
| B. | Mg(OH)2固体投人FeCl3溶液中:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 | |
| C. | Na2S水解:S2-+2H20?H2S+2OH- | |
| D. | H2CO3在水溶液中电离:H2CO3?CO32-+2H+ |
13.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4•7H2O)通过下列反应制备:
FeSO4+Na2CO3═FeCO3↓+Na2SO4,FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)制备FeCO3时,选用的加料方式是c(填字母).
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁.结合图中的绿矾溶解度曲线,完成由烧渣制备绿矾晶体的操作.
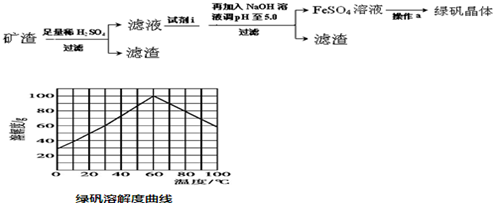
试剂i铁粉,加入试剂i反应的离子方程式为2Fe3++Fe=3Fe2+.操作a为加热到60℃浓缩、冷却结晶、过滤.
FeSO4+Na2CO3═FeCO3↓+Na2SO4,FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁.结合图中的绿矾溶解度曲线,完成由烧渣制备绿矾晶体的操作.

试剂i铁粉,加入试剂i反应的离子方程式为2Fe3++Fe=3Fe2+.操作a为加热到60℃浓缩、冷却结晶、过滤.
14.不能用离子方程式2H++CO32-=H2O+CO2↑表示的化学方程式是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | ||
| C. | K2CO3+2HCl═2KCl+H2O+CO2↑ | D. | Na2CO3+2HNO3═2NaNO3+H2O+CO2↑ |