题目内容
20.下列各组变化中,后者一定包括前者的是( )| A. | 物理变化、化学变化 | B. | 氧化还原反应、分复反应 | ||
| C. | 氧化还原反应、化合反应 | D. | 分解反应、复分解反应 |
分析 A.化学变化中一定含有物理变化;
B.氧化还原反应不一定是分解反应;
C.化合反应不一定是氧化还原反应;
D.由一种物质生成两种或两种以上其它的物质的反应叫分解反应;复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应.
解答 解:A.根据对化学变化和物理变化的关系的了解可知:化学变化中一定含有物理变化,后者一定包括前者,故A正确;
B.氧化还原反应不一定是分解反应,只有有单质生成的分解反应是氧化还原反应,故B错误;
C.化合反应不一定是氧化还原反应,但有单质参加的化合反应属于氧化反应,而氧化还原反应不一定是化合反应,故C错误;
D.由一种物质生成两种或两种以上其它的物质的反应叫分解反应;复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应,分解反应不是复分解反应,故D错误.
故选A.
点评 本题考查化学基本反应类型,难度不大,在解此类题时,首先是理解清各种反应的定义,然后根据定义中知识区别归属关系,属基础性知识考查题.

练习册系列答案
相关题目
10.已知反应:①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,反应热要有正负号,中和热不用,弱酸的中和热减少,下列结论正确的是( )
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
15.25g Fe和S的混合物加热反应后,生成FeS 22g,则混合物中硫粉的质量可能为( )
| A. | 8g | B. | 10g | C. | 11g | D. | 14g |
9.一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质物质的量之比为3:8,则参加反应的Cl2与NaOH物质的量之比为( )
| A. | 8:11 | B. | 3:5 | C. | 1:2 | D. | 18:8 |
5.硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜.
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质).以这种矿石为原料制取硫酸铜的工艺流程如图:
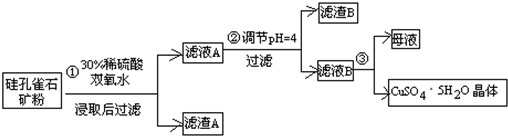
请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;
(2)步骤②调节溶液pH选用的最佳试剂是A
A.CuOB.MgO C.FeCO3D NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
由上表可知:当溶液pH=4时,不能完全除去的离子是Al3+.
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会伴有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)错误(填“正确”或“错误”).
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
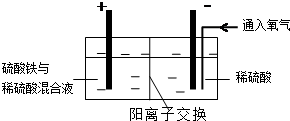
Ⅱ.采用如图装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S 2Fe3++H2S=2Fe2++S↓+2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是Fe2+-e-=Fe3+(用电极反应式表示).
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生.
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是c(H+)>c(SO42-)>c(Cu2+)>c(OH-).
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质).以这种矿石为原料制取硫酸铜的工艺流程如图:

请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;
(2)步骤②调节溶液pH选用的最佳试剂是A
A.CuOB.MgO C.FeCO3D NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会伴有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)错误(填“正确”或“错误”).
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如图装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:

2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S 2Fe3++H2S=2Fe2++S↓+2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是Fe2+-e-=Fe3+(用电极反应式表示).
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生.
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是c(H+)>c(SO42-)>c(Cu2+)>c(OH-).