题目内容
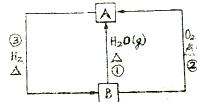
14.酸的强弱除与本性有关外,还与溶剂有关.如HAc和HF在水溶液中部分电离,为弱电解质,本性HAc<HF,若在液氨中两者都为强酸,这种效应称为拉平效应.(1)HAc和HF在液氯中呈强酸性的原因是CH3COOH和HF能电离出H+,液氨能接受H+,两者能相互促进,CH3COOH和HF能达到完全电离.
(2)某些溶剂对酸有区分效应,为区分HCl、HClO4、H2SO4、HNO3的酸性强弱,应选用何种试剂C.
A.水 B.液氯 C.冰醋酸 D.乙二胺
上述四种酸在你所选的试剂中,酸性最强的是HClO4.
(3)在液氯中NaAc+HCl=NaCl+HAc这一反应能否发生否,为什么?因为根据拉平效应:在液氨中CH3COOH和HCl皆为强酸,故反应难以完全进行,而在水溶液中,由于是一强一弱,则可以顺利进行.
分析 (1)因为NH3的碱性比水强,HAc和HF都能在液氨中完全反应,NH3+HAc=NH4Ac,NH3+HF=NH4F,所以HAc和HF完全电离出了H+,所以是强酸;
(2)拉平效应,指在其中,表现出相似甚至相同的酸性,区分效应,指在其中,有的表现酸性,有的表现碱性,从而分开,若是碱,则这4种物质都将表现出酸性,所以BD都属于碱,应该是拉平效应.包括水,也没有足够的区分度,所以,应该是冰醋酸,即有的提供H+的能力比冰醋酸强很多,仍旧是强酸性,而有的,可能与冰醋酸相差不大,从而表现出弱酸性,即区分;
(3)不可以,因为HAc会被NH3反应,所以在液氨中HAc和HCl都是强酸,不会发生这样的反应.
解答 解:(1)CH3COOH和HF能电离出H+,液氨能接受H+,两者能相互促进,CH3COOH和HF能达到完全电离,故CH3COOH和HF在液氨中呈强酸性,
故答案为:CH3COOH和HF能电离出H+,液氨能接受H+,两者能相互促进,CH3COOH和HF能达到完全电离;
(2)显然,在水中这四种酸均为强酸,由(1)中分析可知,在液氨中,这四种酸更是强酸,乙二胺类似于液氨,只有冰醋酸本身能电离出H+,能区分这四种酸的酸性强弱.因为在冰醋酸中,由于H2Ac+的酸性较H3O+为强,而HAc的碱性较水为弱,要某酸(HB)发生反应:HB+HAc?H2Ac++B-,从HClO4→H2SO4→HCl→HNO3将越来越不完全,故表现出酸性最强的是HClO4,
故答案为:C;HClO4;
(3)不能,因为根据拉平效应:在液氨中CH3COOH和HCl皆为强酸,故反应难以完全进行,而在水溶液中,由于是一强一弱,则可以顺利进行,
故答案为:否;因为根据拉平效应:在液氨中CH3COOH和HCl皆为强酸,故反应难以完全进行,而在水溶液中,由于是一强一弱,则可以顺利进行.
点评 本题考查了信息题干的分析应用,注意了解信息所给出的拉平效应实质,掌握和理解信息是关键,题目难度中等.

| A. | 1mol NH4+所含有的电子数为11 NA | |
| B. | 20g氖气所含有的分子数约为 3.01×1023 | |
| C. | 标准状况下,22.4LSO2气体所含的原子数为 NA | |
| D. | 常温常压下,32gO2和O3的混合气体所含原子数为2 NA |
| A. | 8:11 | B. | 3:5 | C. | 1:2 | D. | 18:8 |
| A. | 取少量明矾固体配成稀溶液 | |
| B. | 取少量明矾溶液于2支试管中,分别滴加NaOH溶液(至过量)和酸性BaCl2溶液,观察现象 | |
| C. | 用铂丝蘸取明矾溶液在酒精灯上灼烧,观察火焰颜色 | |
| D. | 取少量明矾固体于干燥试管中加热,观察试管内壁的现象 |
部分物质的有关物理数据如下:?
| 化学式 | 熔点(单位:℃) | 沸点(单位:℃) |
| N2 | -209.86 | -195.8 |
| O2 | -218.4 | -183 |
| CO2 | -57 | / |
| NH3 | -77.3 | -33.35 |
| Cl2 | -101 | -34.6 |
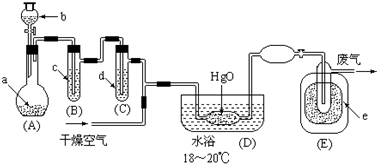
(1)A中深色固体与无色液体制备气体的离子方程式:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)B中盛有液体c是饱和饱和NaCl溶液,C中的液体d是浓硫酸.?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是液态空气 (在干冰、冰水、液态空气、液氨中选择).在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的液氯.
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无橡胶管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而爆炸.

| A. | 用98%的浓硫酸配制溶解所用的4.5mol•L-1的稀硫酸,只需3种玻璃仪器 | |
| B. | 步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量的氯气 | |
| C. | 步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、泥三角、三脚架 | |
| D. | 利用Cu(OH)2 替代CuO也可调节溶液pH而不影响实验结果 |