题目内容
17.向盛有100mL 0.5mol•L-1的硫酸溶液中加入25mL 0.8mol•L-1的氯化钡溶液,过滤后,向滤液中滴加氢氧化钠溶液中和其酸性,需2.5mol•L-1的氢氧化钠溶液( )| A. | 100mL | B. | 40mL | C. | 25mL | D. | 20mL |
分析 硫酸和氯化钡反应生成硫酸钡和盐酸,氢离子物质的量不变,过滤后向滤液中加入NaOH中和酸,盐酸和氢氧化钠中和时二者以1:1反应,据此计算氢氧化钠体积.
解答 解:硫酸和氯化钡反应生成硫酸钡和盐酸,氢离子物质的量不变,过滤后向滤液中加入NaOH中和酸,盐酸和氢氧化钠中和时二者以1:1反应,则V(NaOH)=$\frac{0.5mol/L×2×0.1L}{2.5mol/L}$=40mL,故选B.
点评 本题考查化学方程式有关计算,为高频考点,明确整个过程中反应实质是解本题关键,注意:稀硫酸反应过程中氢离子物质的量与氯化钡物质的量多少无关,为易错点.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
7.已知氨水的密度随浓度的减小而增大,现将50g浓度为cmol•L-1,密度为ρg•cm-3的氨水中加入一定量的水稀释成0.5cmol•L-1,则加入水的体积为( )
| A. | 小于50mL | B. | 等于50mL | C. | 大于50mL | D. | 等于50/ρmL |
9.一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质物质的量之比为3:8,则参加反应的Cl2与NaOH物质的量之比为( )
| A. | 8:11 | B. | 3:5 | C. | 1:2 | D. | 18:8 |
1.氧化二氯是黄棕色具有强烈刺激性的气体.它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1:100)同时反应生成次氯酸溶液.制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO•HgCl2).装置如图,仅铁架台和夹持仪器已略去.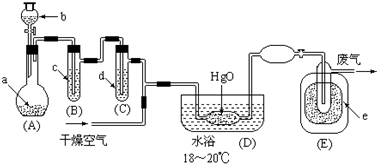
部分物质的有关物理数据如下:?
试回答:?
(1)A中深色固体与无色液体制备气体的离子方程式:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)B中盛有液体c是饱和饱和NaCl溶液,C中的液体d是浓硫酸.?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是液态空气 (在干冰、冰水、液态空气、液氨中选择).在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的液氯.
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无橡胶管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而爆炸.

部分物质的有关物理数据如下:?
| 化学式 | 熔点(单位:℃) | 沸点(单位:℃) |
| N2 | -209.86 | -195.8 |
| O2 | -218.4 | -183 |
| CO2 | -57 | / |
| NH3 | -77.3 | -33.35 |
| Cl2 | -101 | -34.6 |
(1)A中深色固体与无色液体制备气体的离子方程式:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)B中盛有液体c是饱和饱和NaCl溶液,C中的液体d是浓硫酸.?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是液态空气 (在干冰、冰水、液态空气、液氨中选择).在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的液氯.
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无橡胶管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而爆炸.
2.在标况下,一个装满Cl2的容器质量为74.6克;若装满N2则重为66克,那么此容器的容积为( )
| A. | 22.4升 | B. | 44.8升 | C. | 11.2升 | D. | 4.48升 |