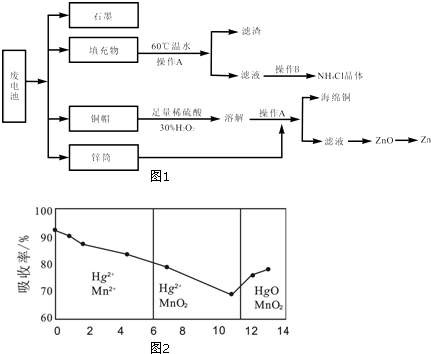
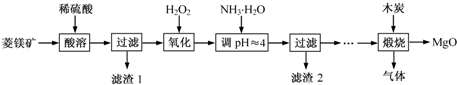
题目内容
1.能正确表示下列反应的离子方程式是( )| A. | NaCN水溶液显碱性:CN-+H2O?HCN+OH- | |
| B. | Mg(OH)2固体投人FeCl3溶液中:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 | |
| C. | Na2S水解:S2-+2H20?H2S+2OH- | |
| D. | H2CO3在水溶液中电离:H2CO3?CO32-+2H+ |
分析 A.NaCN是强碱弱酸盐,氢氰根离子水解导致溶液呈碱性;
B.氯化铁是强酸弱碱盐,铁离子水解导致其水溶液呈酸性,能溶解氢氧化镁生成镁离子和水;
C.硫离子水解分两步,第一步水解程度远远大于第二步水解程度;
D.碳酸是二元弱酸,分两步电离,第一步电离程度远远大于第二步电离程度.
解答 解:A.NaCN是强碱弱酸盐,氢氰根离子水解导致溶液呈碱性,离子方程式为CN-+H2O?HCN+OH-,故A正确;
B.氯化铁是强酸弱碱盐,铁离子水解导致其水溶液呈酸性,能溶解氢氧化镁生成镁离子和水,离子方程式为Mg(OH)2+2H+=2Mg2++2H2O,故B错误;
C.硫离子水解分两步,第一步水解程度远远大于第二步水解程度,其第一步水解离子方程式为S2-+H2O?HS-+OH-,故C错误;
D.碳酸是二元弱酸,分两步电离,第一步电离程度远远大于第二步电离程度,其第一步电离方程式为H2CO3?HCO3-+H+,故D错误;
故选A.
点评 本题考查离子方程式的书写,为高频考点,涉及盐类水解、弱电解质的电离及难溶物的溶解平衡等知识点,侧重考查基本理论及化学用语,知道多元弱酸和多元弱碱电离方程式书写区别,易错选项是B.

练习册系列答案
相关题目
9.一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质物质的量之比为3:8,则参加反应的Cl2与NaOH物质的量之比为( )
| A. | 8:11 | B. | 3:5 | C. | 1:2 | D. | 18:8 |
16.在pH=0或pH=14的水溶液中,都能大量共存的离子组是( )
| A. | Cu2+、K+、Mg2+、NO3- | B. | Na+、Cl-、I-、SO42- | ||
| C. | H2PO4-、NO-3、NH4+、NO3- | D. | S2O32-,AlO2-,Na+,Cl- |
1.氧化二氯是黄棕色具有强烈刺激性的气体.它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1:100)同时反应生成次氯酸溶液.制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO•HgCl2).装置如图,仅铁架台和夹持仪器已略去.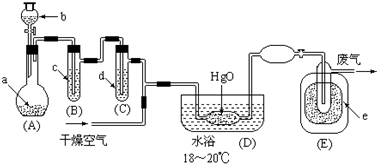
部分物质的有关物理数据如下:?
试回答:?
(1)A中深色固体与无色液体制备气体的离子方程式:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)B中盛有液体c是饱和饱和NaCl溶液,C中的液体d是浓硫酸.?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是液态空气 (在干冰、冰水、液态空气、液氨中选择).在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的液氯.
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无橡胶管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而爆炸.

部分物质的有关物理数据如下:?
| 化学式 | 熔点(单位:℃) | 沸点(单位:℃) |
| N2 | -209.86 | -195.8 |
| O2 | -218.4 | -183 |
| CO2 | -57 | / |
| NH3 | -77.3 | -33.35 |
| Cl2 | -101 | -34.6 |
(1)A中深色固体与无色液体制备气体的离子方程式:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)B中盛有液体c是饱和饱和NaCl溶液,C中的液体d是浓硫酸.?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是液态空气 (在干冰、冰水、液态空气、液氨中选择).在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的液氯.
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无橡胶管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而爆炸.
5.硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜.
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质).以这种矿石为原料制取硫酸铜的工艺流程如图:
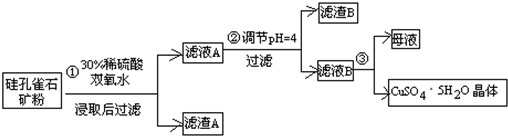
请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;
(2)步骤②调节溶液pH选用的最佳试剂是A
A.CuOB.MgO C.FeCO3D NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
由上表可知:当溶液pH=4时,不能完全除去的离子是Al3+.
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会伴有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)错误(填“正确”或“错误”).
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
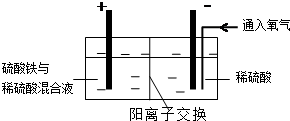
Ⅱ.采用如图装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S 2Fe3++H2S=2Fe2++S↓+2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是Fe2+-e-=Fe3+(用电极反应式表示).
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生.
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是c(H+)>c(SO42-)>c(Cu2+)>c(OH-).
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质).以这种矿石为原料制取硫酸铜的工艺流程如图:

请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;
(2)步骤②调节溶液pH选用的最佳试剂是A
A.CuOB.MgO C.FeCO3D NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会伴有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)错误(填“正确”或“错误”).
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如图装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:

2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S 2Fe3++H2S=2Fe2++S↓+2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是Fe2+-e-=Fe3+(用电极反应式表示).
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生.
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是c(H+)>c(SO42-)>c(Cu2+)>c(OH-).