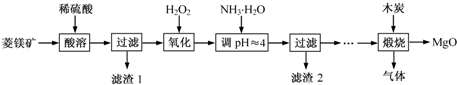
题目内容
13.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4•7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4,FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁.结合图中的绿矾溶解度曲线,完成由烧渣制备绿矾晶体的操作.
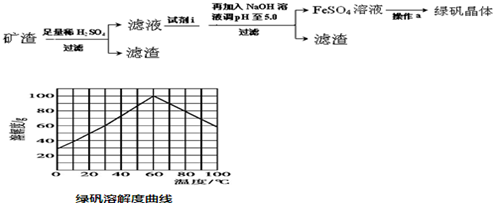
试剂i铁粉,加入试剂i反应的离子方程式为2Fe3++Fe=3Fe2+.操作a为加热到60℃浓缩、冷却结晶、过滤.
分析 (1)利用Na2CO3溶液和FeSO4溶液反应制备FeCO3,由于Na2CO3溶液碱性很强,可能会生成Fe(OH)2沉淀,为避免生成Fe(OH)2沉淀,如果将Na2CO3加入FeSO4溶液中,Fe2+是过量的,并且FeSO4溶液为酸性,Fe2+不易沉淀.因此,CO32-容易与Fe2+结合为沉淀析出,因此应将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中;
(2)判断沉淀是否洗净的方法:取最后一次洗涤的滤液,检测滤液中是否存在未洗涤干净的杂质.首先要弄清沉淀上的杂质是什么,然后再去检测里面的离子.本题中FeCO3的制备是用Na2CO3溶液和FeSO4溶液的反应,因而沉淀表面可能会有Na2SO4杂质,因而应该检验最后一次洗涤滤液中是否含有SO42-,即该题便转化成SO42-的检验;
(3)因+2的Fe元素易被空气中的氧气氧化,制备柠檬酸亚铁过程中应尽量避免与氧气接触.加入铁粉的目的就是与柠檬酸反应产生H2,形成一个无氧的环境.除去过量的铁粉可直接加入适量的柠檬酸,反应也生成了需要的产品柠檬酸亚铁,不会引入杂质.
(4)最后的溶液经浓缩形成柠檬酸亚铁的饱和溶液,要得到尽可能多的柠檬酸亚铁晶体,可加入无水乙醇,可以降低柠檬酸亚铁的溶解度,从而获得更多的产品.
(5)由硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 )制备FeSO4•7H2O晶体,向烧渣中加入足量的稀硫酸,Fe2O3、Al2O3均会与硫酸反应,分别生成Fe2(SO4)2和Al2(SO4)2,SiO2不反应,先过滤把SiO2除去,然后向滤液中加入足量的铁粉,将Fe3+转化成Fe2+,根据金属离子沉淀的pH值,然后通过滴加NaOH溶液调节pH至5.0把Al3+除去,过滤,即得到FeSO4溶液,再根据绿矾溶解度曲线,60℃时绿矾的溶解度最大,可加热浓缩到60℃的饱和溶液,然后放在冰水中冷却,冷却结晶至0℃,此时析出的晶体是最多的,之后过滤,洗涤,低温烘干.
解答 解:(1)利用Na2CO3溶液和FeSO4溶液反应制备FeCO3,由于Na2CO3溶液碱性很强,可能会生成Fe(OH)2沉淀,如果将Na2CO3加入FeSO4溶液中,Fe2+是过量的,并且FeSO4溶液为酸性,Fe2+不易沉淀.因此,CO32-容易与Fe2+结合为沉淀析出,因此为避免生成Fe(OH)2沉淀,应将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中,故选c;
(2)判断沉淀是否洗净的方法:取最后一次洗涤的滤液,检测滤液中是否存在未洗涤干净的杂质.首先要弄清沉淀上的杂质是什么,然后再去检测里面的离子.本题中FeCO3的制备是用Na2CO3溶液和FeSO4溶液的反应,因而沉淀表面可能会有Na2SO4杂质,因而应该检验最后一次洗涤滤液中是否含有SO42-,即该题便转化成SO42-的检验.具体操作为:取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
故答案为:取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
(3)①因+2的Fe元素易被空气中的氧气氧化,制备柠檬酸亚铁过程中应尽量避免与氧气接触.加入铁粉的目的就是与柠檬酸反应产生H2,形成一个无氧的环境,
故答案为:防止+2价的铁元素被氧化;
②除去过量的铁粉可直接加入适量的柠檬酸,反应也生成了需要的产品柠檬酸亚铁,不会引入杂质;
故答案为:加入适量柠檬酸让铁粉反应完全;
(4)最后的溶液经浓缩形成柠檬酸亚铁的饱和溶液,要得到尽可能多的柠檬酸亚铁晶体,可加入无水乙醇,可以降低柠檬酸亚铁的溶解度,从而获得更多的产品;
故答案为:降低柠檬酸亚铁在水中的溶解量,有利于晶体析出;
(5)由硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 )制备FeSO4•7H2O晶体,要弄清楚流程中每一步的原理和注意事项.向烧渣中加入足量的稀硫酸,Fe2O3、Al2O3均会与硫酸反应,分别生成Fe2(SO4)2和Al2(SO4)2,SiO2不反应,先过滤把SiO2除去,然后向滤液中加入足量的铁粉,将Fe3+转化成Fe2+,所以试剂i为铁粉,反应的离子方程式为2Fe3++Fe=3Fe2+,根据金属离子沉淀的pH值,然后通过滴加NaOH溶液调节pH至5.0把Al3+除去,过滤,即得到FeSO4溶液,再根据绿矾溶解度曲线,60℃时绿矾的溶解度最大,可加热浓缩到60℃的饱和溶液,然后放在冰水中冷却,冷却结晶至0℃,此时析出的晶体是最多的,之后过滤,洗涤,低温烘干,所以操作a为加热到60℃浓缩、冷却结晶、过滤,
故答案为:铁粉;2Fe3++Fe=3Fe2+; 加热到60℃浓缩、冷却结晶、过滤.
点评 本题考查了学生在新情境下物质的制备实验中基本的实验技能和对教材相关实验的理解的迁移能力,中档题难度偏大,掌握物质性质和实验技能是解题关键.

 阅读快车系列答案
阅读快车系列答案| A. | 8:11 | B. | 3:5 | C. | 1:2 | D. | 18:8 |
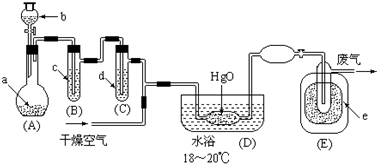
部分物质的有关物理数据如下:?
| 化学式 | 熔点(单位:℃) | 沸点(单位:℃) |
| N2 | -209.86 | -195.8 |
| O2 | -218.4 | -183 |
| CO2 | -57 | / |
| NH3 | -77.3 | -33.35 |
| Cl2 | -101 | -34.6 |
(1)A中深色固体与无色液体制备气体的离子方程式:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)B中盛有液体c是饱和饱和NaCl溶液,C中的液体d是浓硫酸.?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是液态空气 (在干冰、冰水、液态空气、液氨中选择).在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的液氯.
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无橡胶管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而爆炸.

| A. | 用98%的浓硫酸配制溶解所用的4.5mol•L-1的稀硫酸,只需3种玻璃仪器 | |
| B. | 步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量的氯气 | |
| C. | 步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、泥三角、三脚架 | |
| D. | 利用Cu(OH)2 替代CuO也可调节溶液pH而不影响实验结果 |
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质).以这种矿石为原料制取硫酸铜的工艺流程如图:
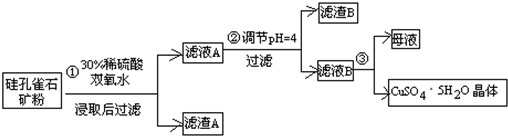
请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;
(2)步骤②调节溶液pH选用的最佳试剂是A
A.CuOB.MgO C.FeCO3D NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会伴有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)错误(填“正确”或“错误”).
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如图装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
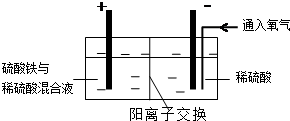
2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S 2Fe3++H2S=2Fe2++S↓+2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是Fe2+-e-=Fe3+(用电极反应式表示).
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生.
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是c(H+)>c(SO42-)>c(Cu2+)>c(OH-).
| A. | 22.4升 | B. | 44.8升 | C. | 11.2升 | D. | 4.48升 |
| A. | 盐酸与碳酸钠溶液反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 碳酸钡溶于醋酸(醋酸是弱酸):BaCO3+2H+=Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应:Na+H2O=Na++OH-+H2↑ |