题目内容
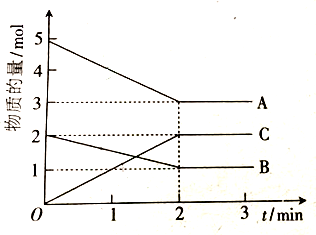
9.将1mol N2和3mol H2通入4L的密闭容器中反应,半分钟后测得H2的物质的量为2.1mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率:①v(N2)=0.15mol•L-1•min-1 ②v(H2)=1.05mol•L-1•min-1③v(NH3)=0.30 mol•L-1•min-1,其中正确的是( )| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
分析 前半分钟内 v(H2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(3-2.1)mol}{4L}}{0.5min}$=0.45 mol•L-1•min-1,同一可逆反应同一时间内,各物质的反应速率之比等于其计量数之比,据此计算氮气、氨气反应速率,据此分析解答.
解答 解:前半分钟内 v(H2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(3-2.1)mol}{4L}}{0.5min}$=0.45 mol•L-1•min-1,同一可逆反应同一时间内,各物质的反应速率之比等于其计量数之比,
v(N2)=$\frac{1}{3}$×v(H2)=$\frac{1}{3}$×0.45 mol•L-1•min-1=0.15mol•L-1•min-1;
v(NH3)=$\frac{2}{3}$×v(H2)=$\frac{2}{3}$×0.45 mol•L-1•min-1=0.30 mol•L-1•min-1,
故选C.
点评 本题考查化学反应速率的有关计算,侧重考查分析解答能力,明确计量数与速率关系是解本题关键,注意速率公式中各个字母含义,题目难度不大.

练习册系列答案
相关题目
19.已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:A$→_{一定条件}^{+X}$ B$→_{一定条件}^{+X}$ C,下列说法错误的是( )
| A. | 若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”,则X为O2 | |
| B. | 若X是生活中常见的过渡金属,A是黄绿色气体,则B→C的离子方程式为Fe+2Fe3+=3Fe2+ | |
| C. | 若C是一种酸式盐,则X一定是CO2 | |
| D. | A既可以为金属单质,也可以为非金属单质 |
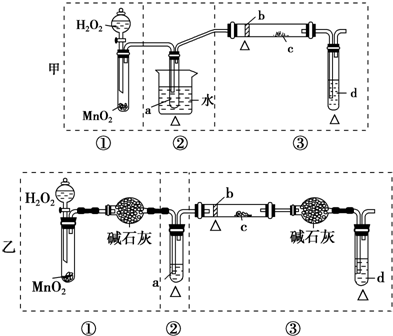
20.如图实验装置能达到实验目的是(夹持仪器未画出)( )
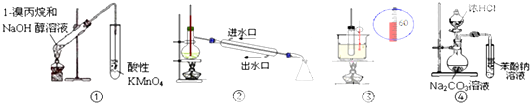

| A. | ①装置用于检验1-溴丙烷消去产物 | B. | ②装置用于石油的分馏 | ||
| C. | ④装置可证明酸性:盐酸>碳酸>苯酚 | D. | ③装置用于实验室制硝基苯 |
17.镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,下列说法正确的是( )
| A. | 镁条作负极,电极反应:Mg-2e-=Mg2+ | |
| B. | 铝片作负极,电极反应:Al+4OH--3e--=[Al(OH)4]- | |
| C. | 电流从Al电极沿导线流向Mg电极 | |
| D. | 铝片上有气泡产生 |
4.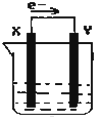 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )| A. | 外电路电流方向为:X→外电路→Y | |
| B. | 若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两极都是金属,则它们的活动顺序为X>Y |
14.下列取代基或微粒中,碳原子都满足最外层为8电子结构的是( )
| A. | 苯 | B. | 乙基(-CH2CH3) | C. | 碳正离子[(CH3)3C+] | D. | 碳烯(:CH2) |
12.碳及其化合物在生产生活中的应用比较广泛,回答下列问题:
(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H1═-285.8KJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H1═-725.5KJ•mol-1
则CO2(g)+3H2(g)═CH2OH(l)+H2O(l)的反应热△H═-131.9KJ/mol;.
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)═CH3OH(l)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
实验1条件下平衡常数K=0.25,a、b之间可能的关系为b=2a+1.
(3)已知CO的转化率(a)与温度(T)、压强(p)的关系如右图所示: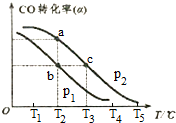
①p1<p2(填“<”、“>”或“═”),先升高温度,后增大压强,能否实现b点到c点的转化?能(填“能”或“不能”),原因是先升高温度,后增大压强,一氧化碳转化率先减小后增大,可以到达C点一氧化碳转化率不变.
②a、c两点的反应速率为v1<v2(填“<”、“>”或“═”)
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是:增大氢气浓度,增大压强、降低温度(答出三条措施)
(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H1═-285.8KJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H1═-725.5KJ•mol-1
则CO2(g)+3H2(g)═CH2OH(l)+H2O(l)的反应热△H═-131.9KJ/mol;.
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)═CH3OH(l)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
| 实验组 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡所需的时间/min | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | |||
| 1 | 650℃ | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
| 2 | 900℃ | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
| 3 | 650℃ | 1.0 | 4.0 | 2.0 | a | b | c | t |
(3)已知CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:

①p1<p2(填“<”、“>”或“═”),先升高温度,后增大压强,能否实现b点到c点的转化?能(填“能”或“不能”),原因是先升高温度,后增大压强,一氧化碳转化率先减小后增大,可以到达C点一氧化碳转化率不变.
②a、c两点的反应速率为v1<v2(填“<”、“>”或“═”)
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是:增大氢气浓度,增大压强、降低温度(答出三条措施)