题目内容
1. 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
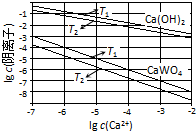
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).(1)图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线.
①计算T1时KSP(CaWO4)=1×10-10.
②T1< T2(填“>”“=”或“<”).
(2)反应Ⅰ的平衡常数K理论值如表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
②该反应的△H>0(填“>”“=”或“<”).
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远.50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol•L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42-的沉淀率为60%,计算实验测得的平衡常数.
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高WO42-的沉淀率.
分析 (1)①T1时KSP(CaWO4)=c(Ca2+)•c(WO42-),根据表中该温度下离子的浓度代入计算即可;
②沉淀的溶解平衡是吸热的过程,温度高,溶度积常数大,据此回答;
(2)①反应平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,据此回答;
②对于吸热反应,温度高,K越大,反之越低,据此回答;
③根据三行式计算实验测得的平衡常数;
(3)根据浓度对反应平衡移动的影响:降低产物浓度,平衡正向移动来回答.
解答 解:(1)①T1时KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×10-5×1×10-5=1×10-10,故答案为:1×10-10;
②沉淀的溶解平衡是吸热的过程,温度高,溶度积常数大,根据表中数据,可以看出下的Ksp较大,所以T1<T2,故答案为:<;
(2)①反应平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,即K=$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$,故答案为:K=$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$;
②根据表中温度和K之间的关系,可以看出温度高,K越大,所以反应是吸热的,故答案为:>;
③WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq)
起始/mol•L-1 0.5 0.5
变化/mol•L-1 0.5×60%=0.3 0.6
平衡/mol•L-1 0.2 1.1
K=$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$=$\frac{1.{1}^{2}}{0.2}$=6.05(mol•L-1),
答:实验测得的平衡常数为6.05(mol•L-1);
(3)向反应混合液中添加适量盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,这样可以提高WO42-的沉淀率,
故答案为:加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高WO42-的沉淀率.
点评 本题考查学生化学平衡常数的有关计算、影响平衡移动的因素、沉淀溶解平衡等方面的知识,属于综合知识的考查题,难度中等.

(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H1═-285.8KJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H1═-725.5KJ•mol-1
则CO2(g)+3H2(g)═CH2OH(l)+H2O(l)的反应热△H═-131.9KJ/mol;.
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)═CH3OH(l)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
| 实验组 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡所需的时间/min | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | |||
| 1 | 650℃ | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
| 2 | 900℃ | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
| 3 | 650℃ | 1.0 | 4.0 | 2.0 | a | b | c | t |
(3)已知CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:
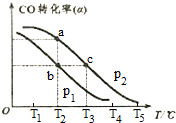
①p1<p2(填“<”、“>”或“═”),先升高温度,后增大压强,能否实现b点到c点的转化?能(填“能”或“不能”),原因是先升高温度,后增大压强,一氧化碳转化率先减小后增大,可以到达C点一氧化碳转化率不变.
②a、c两点的反应速率为v1<v2(填“<”、“>”或“═”)
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是:增大氢气浓度,增大压强、降低温度(答出三条措施)
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.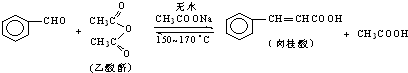
药品物理常数
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
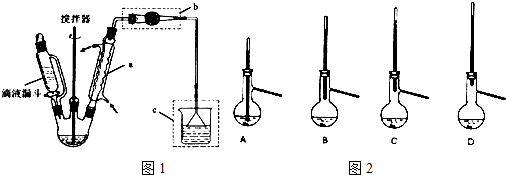
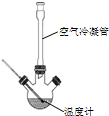
合成:反应装置如图所示.向三颈烧瓶中先后加入研细的无水醋酸钠、苯甲醛和乙酸酐,振荡使之混合均匀. 在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
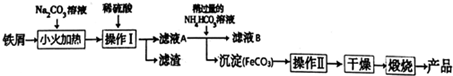
粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
反应混合物$→_{碳酸钠溶液}^{加入饱和}$$→_{苯甲醛}^{蒸馏除去}$$\stackrel{盐酸酸化}{→}$$\stackrel{操作I}{→}$$→_{干燥}^{过滤、洗涤}$肉桂酸晶体
(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
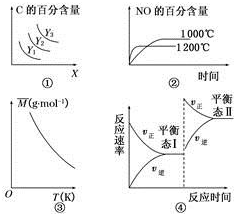
| A. | 对于A(s)+2B(g)?3C(g)△H>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示则Y可能表示温度,x可能表示压强,且Y3>Y2>Y1 | |
| B. | 已知可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1.若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 | |
| C. | 已知反应2A(g)?B(?)+2C(?);△H=+QKJ/mol(Q>0),满足如图③所示的关系,则B、C可能均为气体 | |
| D. | 图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应 |
| A. | 制备Fe(OH)3胶体,通常是将FeCl3固体溶于热 NaOH溶液中 | |
| B. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| D. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
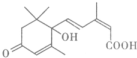
| A. | 其分子式为C15H22O4 | |
| B. | 1 mol该物质与足量NaOH溶液反应,最多消耗2 mol | |
| C. | 一定条件下,l mol该有机物最多可与4 mol氢气发生加成反应 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |