题目内容
【题目】以NOx 为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的 NO(g)和 CO(g)在一定条件下可发生反应生成无毒的N2 和 CO2:
(1)已知:①N2(g)+O2(g)![]() 2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g)
2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H3 =_______。
N2(g)+2CO2(g) △H3 =_______。
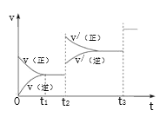
(2)某研究小组在三个容积为 5 L 的恒容密闭容器中,分别充入 0.4mol NO 和 0.4 mol CO,发生反应③ 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:
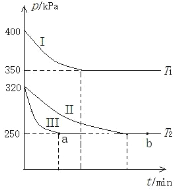
①温度:T1_____T2(填“<”“=”或“>”)。
②CO 的平衡转化率:Ⅰ_____Ⅱ_____Ⅲ(填“<”“=”或“>”)。
③反应速率:a 点的 v逆_____b 点的 v正 (填“<”“=”或“>”)。
④T2 时的平衡常数 Kc=_____。
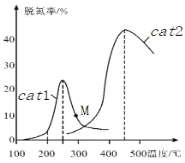
(3)将 NO和 CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即 NO的转化率)如图所示。M 点_____(填“是”或“不是”)对应温度下的平衡脱氮率, 说明理由_________。
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解反应 2N2O=2N2+O2对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高 N2O 的分解速率,反应历程为:
第一步 I2(g)![]() 2I(g)快速平衡,平衡常数为K
2I(g)快速平衡,平衡常数为K
第二步 I(g)+N2O(g)→N2(g)+IO(g) v = k1·c(N2O)·c(I) 慢反应
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+1/2I2(g) 快反应
其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
① k =_____(用含 K 和 k1 的代数式表示)。
②下列表述正确的是_____。
a.IO 为反应的中间产物
b.碘蒸气的浓度大小不会影响 N2O的分解速率
c.第二步对总反应速率起决定作用
d.催化剂会降低反应的活化能,从而影响△H
(5)通过 N2O 传感器可监测环境中 N2O 的含量,其工作原理如图所示
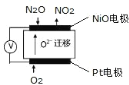
①NiO电极上的电极反应式为_____。
②N2O浓度越高,则电压表读数越_____。(填“高”或“低”)
【答案】-746.5 kJ/mol > < = > 17150 不是 该反应为放热反应,根据曲线cat2可知,M点对应温度的平衡脱氮率应该更高 k1 K1/2 ac N2O - 6e- + 3O2-=2NO2 高
【解析】
∣.(1)已知①N2(g)+O2(g)![]() 2NO(g) △H1= +180.5 kJ·mol-1;②CO+1/2O2=CO2 △H2 = - 283.0 kJ·mol-l;根据盖斯定律,②×2-①可得③,其△H3 = -746.5 kJ/mol,故答案为:-746.5 kJ/mol。
2NO(g) △H1= +180.5 kJ·mol-1;②CO+1/2O2=CO2 △H2 = - 283.0 kJ·mol-l;根据盖斯定律,②×2-①可得③,其△H3 = -746.5 kJ/mol,故答案为:-746.5 kJ/mol。
(2)①温度越高,反应速率越快,先达到平衡,由图可知,温度为T1时先拐,先达到平衡,所以T1>T2,故答案为:>。
②该反应的正反应为放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,已知T1>T2,所以CO的平衡转化率为:Ⅰ<Ⅱ=Ⅲ,故答案为:<;=。
③a、b点是平衡状态,所以正逆反应速率相等,由图像分析可知,a点加入了催化剂,反应速率加快,所以反应速率a点大于b点,a点的v逆大于b点的v正,故答案为:>。
④压强与物质的量成正比关系可得,![]() ,设平衡时,生成的氮气为xmol,则根据三段式:
,设平衡时,生成的氮气为xmol,则根据三段式:
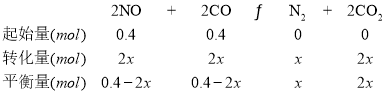
则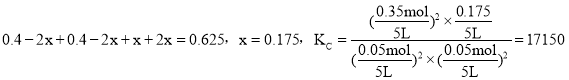 ,故答案为:17150。
,故答案为:17150。
(3)图象分析可知M点不是对应温度下的平衡脱氮率,温度较低时,催化剂的活性偏低;不是平衡脱氮率,因为该反应为放热反应,根据曲线cat2可知,M点对应温度的平衡脱氮率应该更高,故答案为:不是;该反应为放热反应,根据曲线cat2可知,M点对应温度的平衡脱氮率应该更高。
Ⅱ.(4)①根据 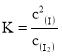 ,v=k·c(N2O)·[c(I2)]0.5,则
,v=k·c(N2O)·[c(I2)]0.5,则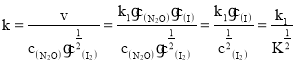 ,故答案为:
,故答案为:![]() ;
;
②a.IO是第二步反应的生成物,第三步反应的反应物,所以IO为反应的中间产物,a正确;
b.含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5,碘蒸气的浓度大小会影响 N2O的分解速率,b错误;
c.反应的快慢取决于慢反应,所以第二步对总反应速率起决定作用,c正确;
d.催化剂会降低反应的活化能,加快反应速率,不影响△H,d错误;故答案为:ac。
(5)①NiO电极上N2O反应生成NO2,N元素的化合价由+1价升高为+4价,发生氧化反应,NiO电极是负极,其电极反应为:N2O - 6e- + 3O2-=2NO2,Pt电极上O2反应生成O2-,O元素的化合价由0价降低为-2价,发生还原反应,Pt电极是正极,其电极反应为:O2 + 4e- =2O2-,故答案为:N2O - 6e- + 3O2-=2NO2。
②根据U=IR,N2O浓度越高,N2O越失去电子生成NO2,转移电子越多,电流越大,电压越大,电压表读数越高,故答案为:高。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案