题目内容
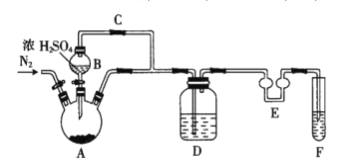
【题目】某研究性学习小组的同学通过查阅资料获得两个信息:一是在CaO存在的条件下,干燥的NaOH与干燥的CH3COONa混合加热可得到CH4;二是在加热条件下CH4可还原CuO。他们设计如下装置(加热仪器省略)制备CH4、还原CuO并验证B中有CO2、H2O生成。
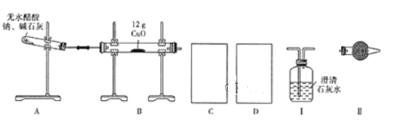
(1)为实现上述实验目的,C、D中的仪器应分别为_______________(填"Ⅰ、Ⅱ"或"Ⅱ、Ⅰ"),Ⅱ中的试剂是________________。
(2)A、B处均需要加热,实验中应先加热______处,表明B中有CO2生成的现象是_________。A中另一种生成物是常见的无机盐,A中反应的化学方程式为_________。
(3)实验表明,即使实验操作、使用试剂完全符合规范实验的要求,制备过程中试管仍会出现破裂情况,试分析其原因:________________。
(4)实验结束后,B中固体全部变成红色,甲同学通过查阅资料后认为,该固体可能是铜、氧化亚铜或者是二者的混合物,同时查得Cu2O在酸性条件下可转化为Cu、Cu2+。为确定红色固体的成分,他设计了如下两种方法。
①取少量红色固体于试管中,再向试管中加入足量的稀硫酸,判断含有Cu2O的现象是________,在常用的酸中,稀硫酸能不能换成稀硝酸_________(填“能”或“不能"),原因是_________。
②称量所得红色固体的质量,当固体质量(m)介于___________之间表明红色固体是Cu与Cu2O的混合物。
【答案】Ⅱ、Ⅰ 无水硫酸铜 A 装置Ⅰ中溶液变浑浊 CH3COONa +NaOH![]() CH4↑ + Na2CO3 高温下,NaOH与玻璃中的SiO2发生反应 得到蓝色溶液 不能 硝酸能与铜单质(Cu2O)反应,无法判断 9.6 g<m<10.8g
CH4↑ + Na2CO3 高温下,NaOH与玻璃中的SiO2发生反应 得到蓝色溶液 不能 硝酸能与铜单质(Cu2O)反应,无法判断 9.6 g<m<10.8g
【解析】
实验目的是制备CH4、还原CuO并验证B中有CO2和H2O,装置A是制备CH4,装置B是甲烷还原CuO,产生的气体中有CO2和H2O,先用无水CuSO4检验水蒸气,然后用澄清石灰水中检验CO2,据此分析。
(1)装置A制备CH4,装置B是CH4与CuO反应生成CO2、H2O,应先检验水,后检验CO2,验证水,常用无水硫酸铜检验,现象是白色变为蓝色,检验CO2常用澄清石灰水,如果澄清石灰水变浑浊,则说明含有CO2,因此C中仪器应是II,D中的仪器为I,II中盛放无水硫酸铜;
(2)CH4是可燃性气体,首先排除装置中的空气,防止发生危险,因此应先加热A处试管,排出装置中的空气,再加热B处硬质玻璃管,以防止装置发生爆炸;根据(1)的分析,表明B中CO2生成的现象是装置I中溶液变浑浊;可先写出CH3COONa + NaOH![]() CH4↑,根据质量守恒、原子守恒确定另外一种无机盐是Na2CO3;
CH4↑,根据质量守恒、原子守恒确定另外一种无机盐是Na2CO3;
(3)玻璃中含有SiO2,高温下NaOH可与玻璃中的SiO2反应,导致玻璃成分改变、试管破裂;
(4)①根据Cu2O在酸性条件下可转化为Cu、Cu2+,Cu单质不能与稀酸反应,因此判断有Cu2O存在,就需要使用能与Cu2O反应但不能与Cu反应的酸,通过观察溶液变蓝色,确定有Cu2O,因此可以用稀硫酸,由于硝酸能与铜单质(Cu2O)反应,无法判断,所以不能用稀硝酸;
②当生成的固体只有单质铜时,由CuO~Cu知,固体质量为![]() =9.6g,当固体只有Cu2O时,由2CuO~Cu2O可知,固体质量为
=9.6g,当固体只有Cu2O时,由2CuO~Cu2O可知,固体质量为![]() =10.8 g,所以当固体质量为9.6g<m<10.8g时,表明红色固体是Cu与Cu2O的混合物。
=10.8 g,所以当固体质量为9.6g<m<10.8g时,表明红色固体是Cu与Cu2O的混合物。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案