题目内容
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)连氨(N2H4)常温下为液态,在空气中迅速完成燃烧生成N2,同时放出大量热,可作导弹、宇航飞船、火箭的燃料。
已知:H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJmol-1
O2(g)═H2O(l)△H1=-285.8kJmol-1
N2(g)+2H2(g)═N2H4(l)△H2=+50.6kJmol-1
则N2H4(l)在空气燃烧生成液态水的热化学方程式为______。
(2)工业上利用氨气生产氢氰酸(HCN)的反应CH4(g)+NH3(g)HCN(g)+3H2(g)△H>0。一定温度下,向2L恒容容器中充入1molCH4(g)和2molNH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为![]() 。0-4min内,用H2表示的该反应速率v(H2)=______。
。0-4min内,用H2表示的该反应速率v(H2)=______。
保持温度和容积不变,再向平衡后的容器中充入2molNH3和2molH2,此时v正______v逆(选填“>”“<”或“=”)。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+(aq)+2NH3(aq)Ag(NH3)2+(aq),其平衡常数的表达式为K稳=______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=______。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
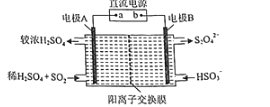
①电极A的电极反应式为______。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为______。
【答案】N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622.2kJ/mol 0.25mol/(Lmin) > 1.76×10-10 SO2+2H2O-2e-=SO42-+4H+ 2NO2+8OH-+4S2O42-=N2+8SO32-+4H2O 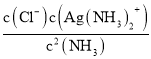
【解析】
(1)已知:①H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJmol-1
O2(g)═H2O(l)△H1=-285.8kJmol-1
②N2(g)+2H2(g)=N2H4(l)△H2=+50.6kJ/mol
盖斯定律计算①×2-②得到N2H4(l)在空气燃烧生成液态水的热化学方程式;
(2)①CH4(g)+NH3(g)HCN(g)+3H2(g)△H>0,计算甲烷反应的物质的量,通过化学方程式三行计算列式得到计算生成氢气物质的量,反应速率v(H2)=![]() ,计算平衡常数,保持温度和容积不变,再向平衡后的容器中充入2molNH3和2molH2,计算此时浓度商和平衡常数比较判断反应进行的方向;
,计算平衡常数,保持温度和容积不变,再向平衡后的容器中充入2molNH3和2molH2,计算此时浓度商和平衡常数比较判断反应进行的方向;
(3)溶液中存在Ag+(aq)+2NH3(aq)Ag( NH3)2+(aq )时,平衡常数K=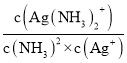 ;常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl (s)+2NH3(aq)Ag( NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.936×10-3,结合平衡常数K=
;常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl (s)+2NH3(aq)Ag( NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.936×10-3,结合平衡常数K=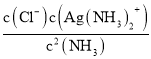 =
=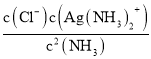 ×
×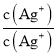 =Ksp(AgCl)K稳[Ag(NH3)2+];
=Ksp(AgCl)K稳[Ag(NH3)2+];
(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,A为阳极,在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成,结合电话守恒电子守恒和原子守恒写出离子方程式。
(1)已知:①H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJmol-1,
O2(g)═H2O(l)△H1=-285.8kJmol-1,
②N2(g)+2H2(g)=N2H4(l)△H2=+50.6kJ/mol,
盖斯定律计算①×2-②得到N2H4(l)在空气燃烧生成液态水的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622.2kJ/mol;
(2)①一定温度下,向2L恒容容器中充入1mol CH4(g)和2mol NH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为66.67%.反应的甲烷物质的量=1mol×66.67%=![]() mol,CH4(g)+NH3(g)HCN(g)+3H2(g)计算得到生成氢气物质的量=
mol,CH4(g)+NH3(g)HCN(g)+3H2(g)计算得到生成氢气物质的量=![]() mol×3=2mol,0~4min內,用H2表示的该反应速率v(H2)=
mol×3=2mol,0~4min內,用H2表示的该反应速率v(H2)=![]() =0.25ol/(Lmin),
=0.25ol/(Lmin),

平衡常数K= 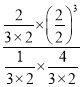 =3,保持温度和容积不变,再句平衡后的容器中充入2molNH3和2molH2,此时浓度商Qc=
=3,保持温度和容积不变,再句平衡后的容器中充入2molNH3和2molH2,此时浓度商Qc=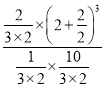 =2.4<K=3,平衡正向进行,v正>v逆;
=2.4<K=3,平衡正向进行,v正>v逆;
(3)溶液中存在Ag+(aq)+2NH3(aq)═Ag( NH3)2+(aq )时,平衡常数K=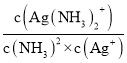 ;常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl (s)+2NH3(aq)Ag( NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.936×10-3,结合平衡常数K=
;常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl (s)+2NH3(aq)Ag( NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.936×10-3,结合平衡常数K=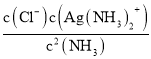 =
=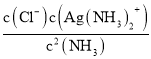 ×
×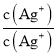 =Ksp(AgCl)K稳[Ag(NH3)2+]=1.936×10-3,Ksp(AgCl)=
=Ksp(AgCl)K稳[Ag(NH3)2+]=1.936×10-3,Ksp(AgCl)=![]() =1.76×10-10;
=1.76×10-10;
(4)①A为阳极,阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO32-生成,该应的离子方程式为:2NO2+8OH-+4S2O42-=N2+8SO32-+4H2O。