题目内容
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2g碳与水蒸气完全反应生成水煤气时,吸收了13.16kJ热量。该反应的热化学方程式为___;该反应在条件下能自发进行___(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
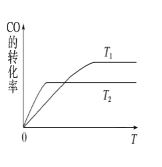
①T1___T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1___(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是___(填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
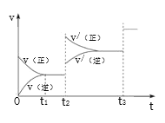
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___;t3时采取的措施可能是___。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=___(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ·mol-1 高温 < > cd 加压 加入催化剂 66.7
【解析】
(1) 1.2g碳的物质的量为0.1mol,与水蒸气完全反应生成CO、H2,吸收13.16kJ热量,则1molC与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,据此书写热化学方程式;依据△G=△H-T△S<0分析判断;
(2)①由达到平衡所需要的时间长短知温度的大小关系,根据温度对平衡移动的影响来回答判断;②根据影响化学平衡的因素分析判断;③由图可知,t2时正逆反应速率均增大,且正反应速率大于逆反应速率,平衡正向移动;t3时正、逆反应速率均增大,正反应速率=逆反应速率,平衡不移动,结合化学平衡的因素分析判断;④同温同体积条件下,气体的物质的量之比=压强之比,结合三段式计算。
(1)1.2g碳的物质的量为0.1mol,与水蒸气完全反应生成CO、H2,吸收13.16kJ热量,则1molC与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJmol-1;
C(s)+H2O(g)=CO(g)+H2(g),该反应是气体体积变大的反应,体系混乱度变大,则△S>0;△G=△H-T△S<0,反应能自发进行,而△H>0,△S>0,说明在高温条件下△G才为负值;
(2)①由达到平衡所需要的时间长短知T1<T2,当温度由T2→T1,即降温时,CO的转化率增大,说明降低温度时平衡向右移动,故正反应是放热反应;放热反应,温度越低,平衡常数越大,则K1>K2;
②A.降低温度,平衡正向移动,CO转化率增大,故错误;
B.将CH3OH(g)从体系中分离,平衡正向移动,CO转化率增大,故错误;
C.使用合适的催化剂,平衡不移动,CO转化率不变,故正确;
D.充入He,使体系总压强增大,各组分的浓度不变,平衡不移动,CO转化率不变,故正确;
答案为:cd;
③由图可知,t2时正、逆反应速率均增大,且正反应速率大于逆反应速率,因反应为气体体积减小的放热反应,可知t2时采取的措施可能是增大压强。t3时正、逆反应速率均增大,正反应速率=逆反应速率,平衡不移动,可知t3时采取的措施可能是加入催化剂;
④同温同体积条件下,气体的物质的量之比等于压强之比,设CO和H2的物质的量为1mol,转化的CO为xmol,则
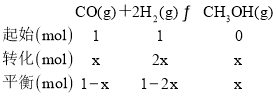
则![]() =
=![]() ,解得:x=0.4,则CO、H2、CH3OH的平衡分压分别为
,解得:x=0.4,则CO、H2、CH3OH的平衡分压分别为![]() ×0.6MPa=0.3MPa、
×0.6MPa=0.3MPa、![]() ×0.6MPa=0.1 MPa、
×0.6MPa=0.1 MPa、![]() ×0.6MPa=0.2 MPa,则KP=
×0.6MPa=0.2 MPa,则KP=![]() =66.7(MPa)-2。
=66.7(MPa)-2。

 出彩同步大试卷系列答案
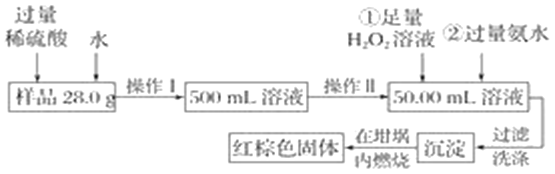
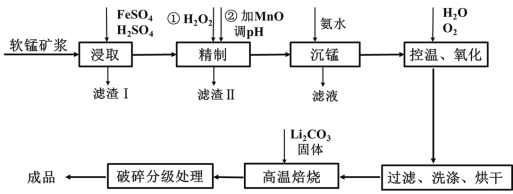
出彩同步大试卷系列答案【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂的流程如图:
已知: lg2=0.3,![]() =8,25℃有关物质的溶度积常数:
=8,25℃有关物质的溶度积常数:
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 5.12×10-33 | 4.0×l0-14 |
(1)已知锂电池放电时正极的电极反应式为:LiMn2O4+e-+Li+ ===Li2Mn2O4,则锰酸锂中锰元素的化合价为____。
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_____,检验还含有Fe2+的方法是______。
(3)“精制”中加入H2O2的量比理论值大的多,其主要原因是______,若所得溶液中锰离子的浓度为1 mol·L-1,则加入氧化锰调节pH的范围为____(当溶液中离子浓度小于10-5 mol·L-1时可以认为沉淀完全)。
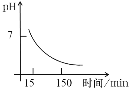
(4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为Mn3O4,若控温氧化时溶液的pH随时间的变化如下图,则15~150 min内滤饼中一定参加反应的成分是______;判断的理由是____(用化学方程式表示)。
(5)写出高温煅烧生成锰酸锂的化学方程式_______。