题目内容
17.已知甲酸经浓硫酸加热脱水可制得CO,以下试剂和仪器(酒精灯未画出,仪器可重复使用)用于测定当CO气流通过Fe2O3粉末后,发生反应的CO在CO总量中所占的百分比.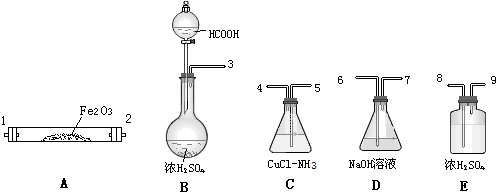
(1)氯化亚铜和氨水溶液吸收CO,实验装置合理的连接顺序自左至右为(填装置接口编号)3、8、9、1、2、6、7、8、9、5、4、6
(2)装置C和D的顺序不能颠倒,原因是CuCl-NH3溶液呈碱性,吸收CO2.
(3)装置B的反应中,浓硫酸是b.a.吸水剂 b.脱水剂 c.氧化剂
(4)设装置C、D的增重为△m(C)、△m(D),发生反应的CO在CO总量中所占的质量分数(CO%)可表示为:CO%=$\frac{\frac{28△m(D)}{44}}{\frac{28△m(D)}{44}+△m(C)}$ 如装置D、E的顺序颠倒,将使实验结果CO%减小.(填增大、减小或不变)
分析 (1)甲酸经浓硫酸加热脱水可制得CO,经浓硫酸干燥后与Fe2O3反应,然后除去用NaOH溶液吸收CO2,再干燥后用氯化亚铜和氨水溶液吸收CO,最后尾气通入NaOH溶液;
(2)CuCl-NH3溶液呈碱性,能吸收CO2;
(3)甲酸经浓硫酸加热脱水可制得CO,可知浓硫酸的作用是脱水机;
(4)根据题意,△m(C)是未反应的CO的质量;△m(D)CO反应后生成的CO2的质量,据此计算CO%;如装置D、E的顺序颠倒,水蒸气进入C装置,CO%减小.
解答 解:(1)甲酸经浓硫酸加热脱水可制得CO,经浓硫酸干燥后与Fe2O3反应,然后除去用NaOH溶液吸收CO2,再干燥后用氯化亚铜和氨水溶液吸收CO,最后尾气通入NaOH溶液;
故答案为:3、8、9、1、2、6、7、8、9、5、4、6;
(2)CuCl-NH3溶液呈碱性,能吸收CO2,故装置C和D的顺序不能颠倒;
故答案为:CuCl-NH3溶液呈碱性,吸收CO2;
(3)甲酸经浓硫酸加热脱水可制得CO,可知浓硫酸的作用是脱水剂,故答案为:b;
(4)根据题意,△m(C)是未反应的CO的质量;△m(D)CO反应后生成的CO2的质量,则发生反应的CO的质量为$\frac{28△m(D)}{44}$,发生反应的CO在CO总量中所占的质量分数(CO%)可表示为:CO%=$\frac{\frac{28△m(D)}{44}}{\frac{28△m(D)}{44}+△m(C)}$;如装置D、E的顺序颠倒,水蒸气进入C装置,导致△m(C)增大,CO%减小;
故答案为:CO%=$\frac{\frac{28△m(D)}{44}}{\frac{28△m(D)}{44}+△m(C)}$;减小.
点评 本题考查了气体的制备及其工业炼铁的装置的选择等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、OH- | |
| D. | 红色溶液中可能大量存在Fe3+、K+、Cl-、SCN- |
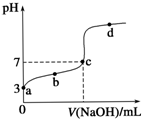 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3 mol•L-1 | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | b、d点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ 均等于K |
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在使酚酞变红的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 在水电离产生的c(OH-)=1×10-14mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH试纸变深红色的溶液中:K+、Fe2+、Cl-、NO3- |
| A. | c(OH-)前者大于后者 | |
| B. | 与同浓度的盐酸反应时的反应速率前者大于后者 | |
| C. | 分别加入1L的0.2 mol/L的HNO3 后一定产生4.48LCO2 | |
| D. | 溶液中阳离子浓度相同 |
①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol;
②H2(g)+S(g)═H2S(g)△H=-20.1kJ/mol.
下列判断一定正确的是( )
| A. | 由①知,氢气的燃烧热为241.8 kJ | |
| B. | 由①、②知,2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-443.4kJ/mol | |
| C. | 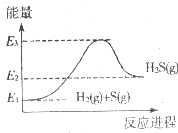 反应②中的能量变化可用如图表示 | |
| D. | 若反应②中改用固态硫,则放热大于20.1 kJ |
 (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)| NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
A、铝的化合物晶体中不存在离子晶体
B、表中只有BCl3、干冰是分子晶体
C、同族元素的氧化物可形成不同类型的晶体
D、不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图(
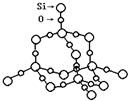 )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.
| 化学键 | Si-O | Si-Si | O=O |
| 键能/KJ•mol-1 | 460 | 176 | 498 |
(3)与铝同周期的磷单质及其化合物有广泛应用.
①三聚磷酸可视为三个磷酸分子(磷酸结构式见图
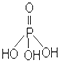 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为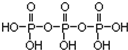 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.②次磷酸钠(NaH2PO2)可用于化学镀镍.NaH2PO2中P元素的化合价为+1;
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)1 Ni2++1 H2PO2-+1H2O→1 Ni+1 H2PO3-+2H+
(b)6H2PO2-+2H+=2P+4H2PO3+3H2
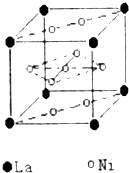
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一镍原子,其它镍原子都在晶胞面上,该晶体的化学式是Ni5La.