题目内容
19.萜品醇可作为消毒剂、抗氧化剂和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )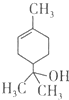
| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C9H16O |
分析 该分子中含有醇羟基、碳碳双键,具有醇和烯烃性质,能发生取代反应、氧化反应、加成反应、还原反应、加聚反应、酯化反应等,据此分析解答.
解答 解:A.含有一个碳碳双键,所以1mol该物质最多能和lmol氢气发生加成反应,故A正确;
B.该分子中除了含有C、H元素外还含有O元素,所以不是烃,属于烃的含氧衍生物,故B错误;
C.含有碳碳双键,所以能和溴发生加成反应而使溴水褪色,故C正确;
D.根据结构简式知,其分子式为C10H18O,故D错误;
故选BD.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烃的概念、烯烃及醇的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列有关说法正确的是( )
| A. | 为减小酸碱中和滴定的使用误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(I)△H=-57.3kJ•mol-1,可知100mL 0.1mol•L-1的氨水混合,放出的热量等于0.573kJ |
7.下列有关溶液组成的描述合理的是( )
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、OH- | |
| D. | 红色溶液中可能大量存在Fe3+、K+、Cl-、SCN- |
4.下列说法正确的是( )
| A. | 加热NH4C1晶体时,将湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| D. | 通过灼热的镁粉除去N2中的O2 |
11.电解是工业生产的常用方法.某研究性小组进行以下相关探究:
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
化学小组分析提出:①白色物质为CuCl.
②红色物质可能有Cu;或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2△_2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是W1−W235.5mol.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为20m−nV40mol•L-1.
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
②红色物质可能有Cu;或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2△_2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是W1−W235.5mol.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为20m−nV40mol•L-1.
8.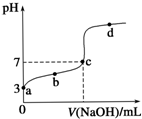 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3 mol•L-1 | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | b、d点表示的溶液中c(CH3COO−)•c(H+)c(CH3COOH) 均等于K |
9.已知:
①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol;
②H2(g)+S(g)═H2S(g)△H=-20.1kJ/mol.
下列判断一定正确的是( )
①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol;
②H2(g)+S(g)═H2S(g)△H=-20.1kJ/mol.
下列判断一定正确的是( )
| A. | 由①知,氢气的燃烧热为241.8 kJ | |
| B. | 由①、②知,2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-443.4kJ/mol | |
| C. |  反应②中的能量变化可用如图表示 | |
| D. | 若反应②中改用固态硫,则放热大于20.1 kJ |
 .
.