题目内容
16.锌粉、铝粉的混合物44g与一定量浓度为17.25%的硫酸溶液恰好反应,将溶液蒸发结晶得干燥的无水固体140g,则放出的气体在标准状况下的体积为( )| A. | 无法计算 | B. | 6.72L | C. | 33.6L | D. | 22.4L |
分析 金属44g,最终得到的140g固体为硫酸锌、硫酸铝的质量之和,则固体中硫酸根的质量为140g-44g=96g,根据n=$\frac{m}{M}$计算硫酸根的物质的量,由硫酸的化学式反应可知n(氢气)=n(硫酸根),再根据m=nVm计算生成氢气的体积.
解答 解:44g金属完全反应后最终得到的116g固体为硫酸锌、硫酸铝的质量之和,则固体中硫酸根的质量为:140g-44g=96g,故硫酸根的物质的量为:$\frac{96g}{96g/mol}$=1mol,
由硫酸的化学式反应可知:n(氢气)=n(硫酸根)=1mol,
所以生成氢气的体积为:1mol×22.4L/mol=22.4L,
故选D.
点评 本题考查混合物反应的计算,题目难度中等,把握金属与硫酸的反应及氢气与硫酸根的关系为解答的关键,试题侧重对学生分析与计算能力的考查.

练习册系列答案
相关题目
6.下列叙述中,不正确的是( )
| A. | 难溶物Ba3(PO4)2的溶度积表达式为Ksp=c(Ba2+)3•c(PO43-)2 | |
| B. | aA(g)+bB(g)?cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、容器体积保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |
7.下列有关溶液组成的描述合理的是( )
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、OH- | |
| D. | 红色溶液中可能大量存在Fe3+、K+、Cl-、SCN- |
4.下列说法正确的是( )
| A. | 加热NH4C1晶体时,将湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| D. | 通过灼热的镁粉除去N2中的O2 |
11.电解是工业生产的常用方法.某研究性小组进行以下相关探究:
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
化学小组分析提出:①白色物质为CuCl.
②红色物质可能有Cu;或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是$\frac{{W}_{1}-{W}_{2}}{35.5}$mol.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为$\frac{20m-nV}{40}$mol•L-1.
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
②红色物质可能有Cu;或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是$\frac{{W}_{1}-{W}_{2}}{35.5}$mol.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为$\frac{20m-nV}{40}$mol•L-1.
1.随着社会的发展,人们日益重视环境问题,下列说法不正确的是( )
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 | |
| B. | 对废旧电池进行回收处理主要是为了防止重金属污染水源和土壤 | |
| C. | 采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 | |
| D. | PM2.5是指大气中直径接近于2.5×10-6m的细颗粒物,它们分散在空气中形成的混合物具有丁达尔效应 |
8.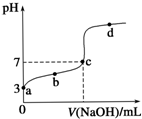 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3 mol•L-1 | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | b、d点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ 均等于K |
5.下列各组离子一定能大量共存的是( )
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在使酚酞变红的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 在水电离产生的c(OH-)=1×10-14mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH试纸变深红色的溶液中:K+、Fe2+、Cl-、NO3- |