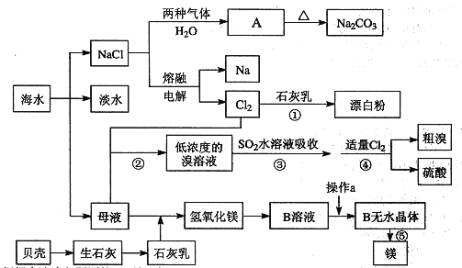
题目内容
【题目】从本质入手看物质及其能量的变化,可以让我们更加深入的去理解所学知识的内涵及外延应用。对于《原电池》这部分知识也是如此,如图是原电池的基本构造模型:

(1)若a和b的电极材料为Al或Mg。
①若c为稀NaOH溶液时,则a的电极材料为__,该极电极方程式为___。
②若c为稀H2SO4时,则a的电极材料为___,该极电极方程式为__。
(2)对于原电池的应用,以下说法正确的是__。
A.选择构成原电池两极材料时,必须选择活泼性不同的两种金属材料
B.构成原电池时,负极材料的活泼性一定比正极材料的强
C.构成原电池时,作为负极材料的金属受到保护
D.从能量转化角度去看,如图的氧化还原反应能量变化曲线,则不能够设计原电池

【答案】Al Al-3e-+4OH-=AlO2-+2H2O Mg Mg-2e-=Mg2+ D
【解析】
(1)原电池中电极由负极经导线流向正极,所以a为负极发生氧化反应,b为正极发生还原反应。
(1)①若c为稀NaOH溶液时,电池总反应应为2Al+2H2O+2OH-=2AlO2-+3H2↑,Al被氧化做负极,即a的电极材料为Al,该电极方程式为Al-3e-+4OH-=AlO2-+2H2O;
②若c为稀H2SO4时,Mg比Al活泼,所以电池总反应式为Mg+2H+=Mg2++H2↑,Mg被氧化做负极,即a的电极材料为Mg,电极方程式为:Mg-2e-=Mg2+;
(2)A.构成原电池两极材料不一定选择活泼性不同的两种金属材料,可以是活泼性相同的Pt电极、也可以是非金属材料,如燃料原电池的两极材料常选择石墨电极,故A错误;
B.碱性原电池中,作为负极的材料的活泼性不一定比正极材料的强,如Al-Mg-NaOH原电池中,活泼金属Mg作正极,Al作负极,故B错误;
C.原电池中正极发生得到电子的还原反应,所以作为正极材料的金属受到保护,而负极材料的金属会加速腐蚀,故C错误;
D.原电池中发生氧化还原反应,会以电能的形式放出能量,所以一般为放热的氧化还原反应,而图示反应为吸热反应,所以从能量转化角度看,一般不设计成原电池或不能够设计原电池,故D正确;
综上所述选D。

 名校课堂系列答案
名校课堂系列答案【题目】含锌废渣及粉尘是危险废物,碱浸电解法处理可得锌粉。但若其中存在氯,则锌质量就严重下降,对电极板也有严重腐蚀作用。工业上模拟碱浸电解法处理含锌质量分数为16%的废料(主要成分为ZnO、Zn(OH)2、ZnSO4及PbCO3、Fe2O3、Cu杂质)工艺如图:
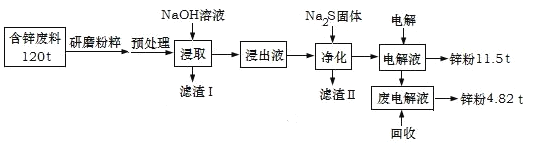
ⅰ.浸出液中含有[Zn(OH)4]2-和[Pb(OH)4]2-等离子
ⅱ.滤渣Ⅱ的主要成分为:Na2Pb(OH)xS![]()
(1)从物质分类的角度看,ZnO属于__,其与NaOH溶液发生反应的离子方程式为__。
(2)“滤渣Ⅰ”的主要成分为___。
(3)下表是“预处理”的2种除氯方案中粉尘氯的去除率和锌损失率分析表格可知,首选的“除氯剂”为___,原因是____。
除氯剂 | 碱(NaOH) | 碳酸钠 |
氯去除率/% | 78.75 | 83.69 |
锌损失率/% | 0.26 | 0.28 |
价格/t | 7200元 | 3600元 |
(4)“电解”过程中阴极的电极反应式为____。
(5)锌的总回收率为____。