题目内容
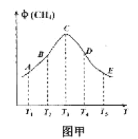
【题目】向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s) ![]() bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
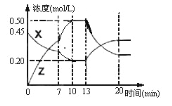
A. 根据上图可求得方程式中a∶b=1:3
B. 推测在第7min时曲线变化的原因可能是升温
C. 推测在第13min时曲线变化的原因可能是降温
D. 用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
【答案】B
【解析】
A.0~10min内X的变化量是0.25mol/L,Z的变化量是0.5mol/L,所以a:b=1:2,故A错误;
B.7min时从图中可以看出速率加快,但浓度没有改变,所以不是增大压强和增加浓度,有可能是升高温度,故B正确;
C. 13min时从图中可以看出X浓度增加,Z的浓度减小,说明平衡逆向移动,不可能是降温,故C错误;
D. 0~10min内该反应的平均速率为v(X)=![]() ,故D错误;
,故D错误;
正确答案:B。

练习册系列答案
相关题目
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)图中表示NO2的变化的曲线是___(填字母);
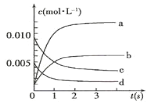
(2)800℃,反应达到平衡时,NO的转化率是___ ;
(3)用O2表示从0~2s内该反应的平均速率v=___。