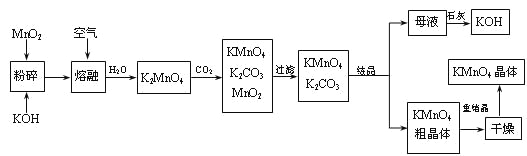
��Ŀ����
����Ŀ���Ӻ�ˮ����ȡһЩ��Ҫ�Ļ�����Ʒ�Ĺ���������ͼ��ʾ��
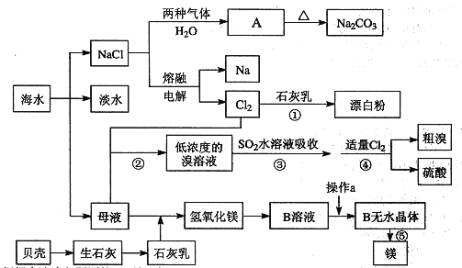
������������ͼ�ش��������⣺
(1)ͼ��A�Ļ�ѧʽΪ ___________������ȡA�Ĺ���������NaCl��Һ���Ⱥ�ͨ���������壬��ͨ������Ļ�ѧʽΪ________________��
(2)��ˮ���������ķ�����_____________________����д��2�ּ��ɣ�
(3)���̢ݵĻ�ѧ����ʽΪ _________________________________��
(4)���̢���SO2ˮ��Һ�����嵥�ʣ������ʿɴ�93%����������ǿ�ᣬд����Ӧ�����ӷ���ʽ________________________________��
(5)���̢ڵ����̢ܵı仯Ϊ��Br��Br2��Br��Br2������Ŀ����__________��
���𰸡�NaHCO3 CO2 MgCl2![]() Mg+Cl2�� �������ӽ��������������� Br2+SO2+2H2O=4H++2Br-+SO42- ������
Mg+Cl2�� �������ӽ��������������� Br2+SO2+2H2O=4H++2Br-+SO42- ������
��������
������������ͼ��������ˮͨ����ˮɹ�Ρ���ˮ�����õ��Ȼ��ơ�ĸҺ���Ȼ�����Һ��ͨ�백����������̼������Ӧ����̼�����ƾ���A���Ȼ�泥�̼�����ƾ������ȷֽ�����̼���ơ�������̼��ˮ���õ������Ȼ���ͨ����������Ȼ��Ƶõ��������ƣ�����ͨ��ʯ���鷴Ӧ�����Ȼ��ơ�������ƺ�ˮ�����õ�Ư�ۣ�����ͨ��ĸҺ�У����������������ɵ�Ũ�ȵ��嵥����Һ���ö������������嵥�����������ӣ���ͨ��ͨ���������������������嵥�ʣ��ڹ����и������壬�õ���������ᡣ���Ƿֽ�������ʯ������ˮ�õ�ʯ���飬����ĸҺ�У��ɳ���þ��������������þ���������˺���������ܽ�������þ�õ�B��ҺΪ�Ȼ�þ��Һ��Ȼ�����Ȼ��������������Ȼ�þ��Һ�õ���ˮ�Ȼ�þ����������Ȼ�þ����þ��������
(1)����A���ȷֽ�����Na2CO3֪��A�Ļ�ѧʽΪ NaHCO3������A�ķ����Ǻ����Ƽ����ΪNH3��������ˮ����CO2��ˮ���ܽ�Ȳ��ϣ���������ˮ��Ϊ�˻�ý϶��NaHCO3���壬Ҫ����ʳ��ˮ��ͨ�백���������Ϳ����ո����CO2����������NaHCO3����������ȡNaHCO3�Ĺ���������NaCl��Һ����ͨ��NH3����ͨ��CO2��(2)��ˮ���������ķ����������������������ӽ���Ĥ���ȣ�
(3)���̢�ӦΪ������ڵ���ˮMgCl2��ȡMg����ѧ����ʽΪMgCl2(����)![]() Mg+Cl2����
Mg+Cl2����
(4)���̢���SO2����ˮ����������Ҳ�����ᣬ��Ӧ�����ӷ���ʽΪSO2+Br2+2H2O=4H++SO42-+2Br-��
(5)���ں�ˮ����Ļ�����Ũ��С�����Թ��̢ڵõ����ǵ��嵥����Һ��Ũ��̫�ͣ����Թ��̢ڵ����̢ܵı仯ΪBr-��Br2��Br-��Br2����Ŀ�����������Ũ�ȣ�ʵ����ĸ�����

����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��ͼ�б�ʾNO2�ı仯��������___(����ĸ)��
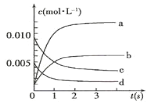
��2��800�棬��Ӧ�ﵽƽ��ʱ��NO��ת������___����
��3����O2��ʾ��0~2s�ڸ÷�Ӧ��ƽ������v=___��
����Ŀ�����Ȼ���(PCl3)��һ�������л��ϳɵ���Ҫ������ʵ���ҳ��ú���������Cl2��ȡPCl3��װ����ͼ��ʾ��
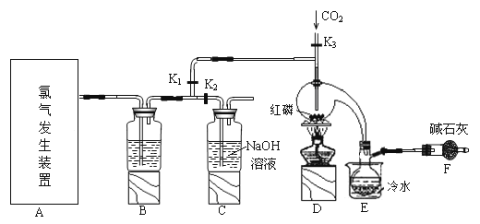
��֪������������Cl2��Ӧ����PCl3�������Cl2��Ӧ����PCl5��PCl3��O2������POCl3(��������)�� POCl3����PCl3��PCl3��ˮ��ǿ��ˮ������H3PO3��HCl��PCl3��POCl3���۷е���±���
���� | ��Է������� | �۵�/�� | �е�/�� |
PCl3 | 137.5 | -112 | 75.5 |
POCl3 | 153.5 | 2 | 105.3 |
��ش��������⣺
��1�������ͼ��ѡ���Ʊ������ķ���װ��
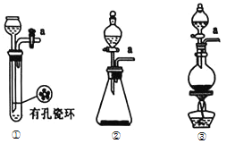
��ѡ�õ�װ����____������ţ�����Ӧ�����ӷ���ʽΪ____��
��2��B����ʢ�Լ���_____��
��3��E����ˮ��������____��
��4������F��������____��F�м�ʯ�ҵ�������___��
��5��ʵ���ƵõĴֲ�Ʒ�г�����POCl3��PCl5�ȣ���������ȳ�ȥPCl5����ͨ��__����������ƣ����ɵõ��ϴ�����PCl3��
��6��ͨ�����淽���ɲⶨ��Ʒ��PCl3������������
��Ѹ�ٳ�ȡ1.00g��Ʒ����ˮ��Ӧ�����250mL��Һ��
��ȡ������Һ25.00mL�������м���10.00mL0.1000mol/L��ˮ(����)����ַ�Ӧ��
�����������Һ�м��뼸�ε�����Һ����0.1000 mol/L��Na2S2O3��Һ�ζ���
���ظ��ڡ��۲�����ƽ������0.1000 mol/LNa2S2O3��Һ8.00mL��
��֪��H3PO3+I2+H2O=H3PO4+2HI��I2+2Na2S2O3=2NaI+Na2S4O6�������������ݣ�����ⶨ������û��������Ӧ���ò�Ʒ��PCl3����������Ϊ___������3λ��Ч���֣���
����Ŀ��Ŀǰ���ܽ��ȶ����ڵ��ȵ���������Cl2O��ClO2��Cl2O7�ȡ��й����ݼ�����
��ѧʽ | Cl2O | ClO2 | Cl2O7 |
�е�/�� | 3.8 | 11.0 | 82.0 |
��ش��������⣺
(1)���¡���ѹ�£������������������������__________��
(2)Cl2O7�����������������ˮ��Ӧ�����ӷ���ʽΪ__________��
(3)ClO2��һ�ֳ��õ����������ҹ���2000��������ClO2��������������ˮ����������������ˮʱ��ClO2���ɽ�ˮ�е�Fe2+��Mn2+��ת����Fe(OH)3��MnO2���������ȥ��˵��ClO2����__________�ԡ�
(4)��ҵ�Ͽ��������з�Ӧ�Ʊ�ClO2��2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4�����õ����ŷ���ʾ���÷�Ӧ����ת�Ƶķ������Ŀ______________��
(5)��ҵ���Ʊ�ClO2�ķ�Ӧԭ��Ϊ��2NaClO3+4HCl(Ũ)=2ClO2��+Cl2��+2H2O+2NaCl��
��Ũ�����ڷ�Ӧ����ʾ������������__________(�����)��
A����ԭ�� B�������� C������
����������Ӧ�в���0.1molClO2����ת�Ƶĵ�����Ϊ__________��