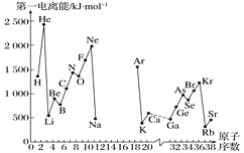
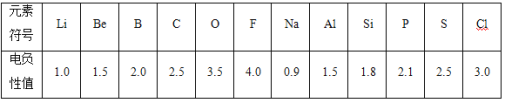
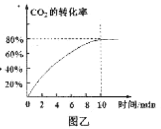
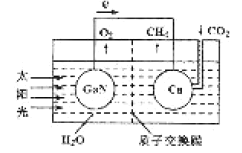
题目内容
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知![]()
![]() ,则
,则![]() 固体与稀盐酸完全反应,放出的热量即为
固体与稀盐酸完全反应,放出的热量即为![]()
B. 已知![]()
![]()
![]()
![]() 则
则![]()
C. 已知![]() ,则反应物总能量小于生成物总能量
,则反应物总能量小于生成物总能量
D. 已知![]() (白磷,s)=
(白磷,s)=![]() (红磷,s)
(红磷,s)![]() ,则白磷比红磷稳定
,则白磷比红磷稳定
【答案】B
【解析】
A.NaOH固体溶于水放热,由中和热可知,40gNaOH固体与稀盐酸完全反应,放出的热量大于57.3kJ,故A错误;
B.相同的C,完全燃烧放出热量多,焓变为负,则完全燃烧时焓变小,可知△H1<△H2,故B正确;
C.由H2(g)+Cl2(g)=2HCl△H=-184.6kJ/mol可知反应物总能量大于生成物总能量,故C错误;
D.由P(白磷,s)=P(红磷,s)△H<0可知红磷能量低,则红磷比白磷稳定,故D错误;
故答案选B。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案【题目】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。
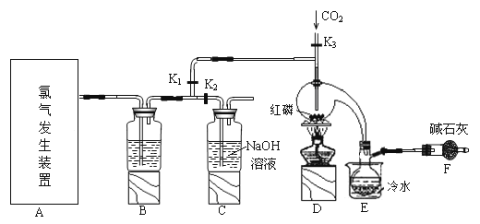
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ |
PCl3 | 137.5 | -112 | 75.5 |
POCl3 | 153.5 | 2 | 105.3 |
请回答下列问题:
(1)请从下图中选择制备氯气的发生装置
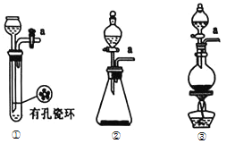
你选用的装置是____(填序号),反应的离子方程式为____。
(2)B中所盛试剂是_____。
(3)E中冷水的作用是____。
(4)仪器F的名称是____;F中碱石灰的作用是___。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过__(填操作名称)即可得到较纯净的PCl3。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/LNa2S2O3溶液8.00mL。
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为___(保留3位有效数字)。