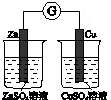
题目内容
6.现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸的浓度为4mol/L,稀硝酸的浓度为2mol/L.取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到的气体成分为NO、H2、;体积分别是0.448L、0.224L.(假设HNO3只被还原为NO)分析 稀硫酸浓度为4mol/L,稀硝酸的浓度为2mol/L.取10mL混合酸,n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,n(NO3-)=0.01L×2mol/L=0.02mol,由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,以此计算该题.
解答 解:10mL混合酸中含有氢离子总的物质的量为:n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,硝酸根离子总物质的量为:n(NO3-)=0.01L×2mol/L=0.02mol,应用铁过量,根据反应3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O可知氢离子过量,
则发生反应为:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O、Fe+2H+=Fe2++H2↑,
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
0.02mol 0.08mol 0.02mol
标况下生成的0.02molNO的体积为:22.4L/mol×0.02mol=0.448L,
反应后剩余氢离子为:n(H+)=0.1mol-0.08mol=0.02mol,
Fe+2H+=Fe2++H2↑
0.02mol 0.01mol
标况下生成的0.01mol氢气的体积为:22.4L/mol×0.01mol=0.224L,
故答案为:NO、H2;0.448;0.224.
点评 本题考查混合物反应的计算,题目难度中等,解答时需要明确铁过量,根据n(H+)、n(NO3-)判断发生反应类型,然后根据反应方程式计算出生成的气体的物质的量及标况下的体积.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
16.现有乳酸( 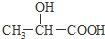 )和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )
)和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )
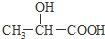 )和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )
)和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )| A. | 2 mol | B. | 2.25 mol | C. | 3 mol | D. | 3.75 mol |
17.下列说法正确的是( )
| A. | 反应条件是加热的反应都是吸热反应 | |
| B. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| C. | 物质相互混合就能发生的反应,是放热反应 | |
| D. | 放热的化学反应不需要加热就能发生 |
14.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①干燥氯气;②液氯;③新制氯水;④氯气的苯溶液;⑤盐酸;⑥盐酸酸化的漂白粉溶液.
①干燥氯气;②液氯;③新制氯水;④氯气的苯溶液;⑤盐酸;⑥盐酸酸化的漂白粉溶液.
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
1.甲醇、氧气和强碱溶液作电解质的手机电池中的反应为2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O,有关说法正确的是( )
| A. | 充电时化学能转化为电能 | |
| B. | 放电时,负极电极反应式为:CH3OH+8OH--6e-=CO${\;}_{3}^{2-}$+6H2O | |
| C. | 标况下,通入的11.2L氧气完全反应有1mol电子转移 | |
| D. | 充电时电解质溶液的碱性逐渐减小 |

 .9g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L,如果与足量的小苏打溶液完全反应产生的气体在标准状况下的体积是22.4L.
.9g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L,如果与足量的小苏打溶液完全反应产生的气体在标准状况下的体积是22.4L.