题目内容
11.已知可逆反应2A(g)+B(g)═2C(g),向容积为0.5L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.040mol•L-1,放出热量Q1kJ.(1)能说明上述反应已经达到化学平衡状态的是bcf(填字母编号)
a.v(C)=2v(B)
b.单位时间内生成2mol A的同时消耗1molB
c.容器内压强保持不变
d.容器内气体的密度保持不变
e.单位时间内生成1molB的同时生成2mol A
f.容器内气体的平均分子量保持不变
g.容器内气体的质量保持不变
h.容器内A物质的浓度是B物质的2倍
(2)上述反应中A的转化率a(A)=40%.
(3)请写出上述反应的热化学方程式2A(g)+B(g)═2C(g)△H=-100Q1kJ•mol-1
(4)500℃时,上述反应的化学平衡常数K=$\frac{400}{27}$.
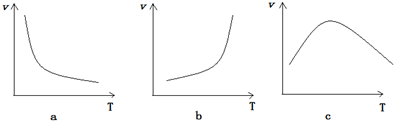
(5)一般,升高温度,化学反应的反应速率会增大.从以下图象中选择符合酶催化作用的化学反应速率随温度变化的特征c.
分析 (1)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,也可判断平衡状态;
(2)反应开始前,c(A)=$\frac{0.05mol}{0.5L}$=0.1mol/L,平衡时c(C)=0.04mol/L,据反应方程式计算;
(3)根据平衡时c(C)=0.04mol/L时放热Q1kJ,计算焓变;
(4)反应开始时,c(A)=0.1mol/L,c(B)=$\frac{0.025mol}{0.5L}$=0.05mol/L,平衡时c(C)=0.04mol/L,计算平衡常数;
(5)升温反应速率加快,但温度太高,酶的活性减弱,催化作用减弱,据此分析.
解答 解:(1)a、v(C)=2v(B),不能判断正反应速率和逆反应速率的关系,所以不能说明已经达到平衡状态,故错误;
b、单位时间内生成2mol A的同时消耗1molB,说明v逆(A)=2v逆(B)=2v正(B),故正确;
c、反应后气体的物质的量减小,所以容器内的压强减小,所以容器内压强保持不变,即是平衡状态,故正确;
d、反应后气体的体积不变,气体的质量也不变,所以容器内气体的密度始终保持不变,不能判断平衡状态,故错误;
e、单位时间内生成1molB的同时生成2mol A都是逆反应速率,不能说明反应达到平衡状态,故错误;
f、气体的平均分子量=$\frac{混合气体的质量总和}{混合气体的物质的量总和}$,反应前后气体质量不变,物质的量不同,所以气体的平均分子量不变,说明混合气体的物质的量不变,反应达到平衡状态,故正确;
g、混合气体的质量始终不变,所以混合气体的质量不变不能说明反应达到平衡状态,故错误;
h、A与B的浓度大小,决定于开始加入反应物的多少,与平衡状态无关,故错误;
故答案为:bcf;
(2)反应开始前,c(A)=$\frac{0.05mol}{0.5L}$=0.1mol/L,平衡时c(C)=0.04mol/L,则反应的c(A)=0.04mol/L,所以A的转化率为$\frac{0.04mol/L}{0.1mol/L}$×100%=40%,
故答案为:40%;
(3)根据平衡时c(C)=0.04mol/L时放热Q1kJ,可知2molA完全反应生成2molC放热100Q 1kJ,反应的热化学方程式为:2A(g)+B(g)═2C(g)△H=-100Q 1kJ•mol-1,故答案为:2A(g)+B(g)═2C(g)△H=-100Q 1kJ•mol-1;
(4)反应开始时,c(A)=0.1mol/L,c(B)=$\frac{0.025mol}{0.5L}$=0.05mol/L,平衡时c(C)=0.04mol/L,则平衡时,c(A)=0.06mol/L,c(B)=0.025mol/L,化学平衡常数K=$\frac{[C]^{2}}{[A]^{2}•[B]}$=$\frac{0.0{4}^{2}}{0.0{6}^{2}×0.025}$=$\frac{400}{27}$,故答案为:$\frac{400}{27}$;
(5)升温反应速率加快,但温度太高,酶的活性减弱,催化作用减弱,图c符合题意,故答案为:c.
点评 本题考查了化学平衡状态的判断、转化率的计算、热化学方程式书写、化学平衡常数的计算、酶的催化作用,都是高考高频考点,注意掌握.

| A. | 氨水能与氯化镁反应生成MgCl2溶液反应 | |
| B. | 氨气易溶于水 | |
| C. | 0.1摩尔/升的NH4Cl的pH值约为5 | |
| D. | 氨水可以使得酚酞试液变红 |
| A. | 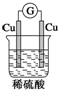 | B. | 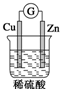 | C. | 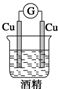 | D. | 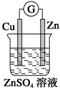 |
| A. | K3C60中既有离子键又有非极性键 | |
| B. | 1mol K3C60中含有的离子数目为3NA | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式不能写作KC20 |
| A. | 1mol/L | B. | 2mol/L | C. | 2.5mol/L | D. | 3mol/L |
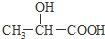 )和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )
)和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )| A. | 2 mol | B. | 2.25 mol | C. | 3 mol | D. | 3.75 mol |
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 第VIIA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 元素的最高正价数均等于该元素原子的最外层电子数 |
| A. | 充电时化学能转化为电能 | |
| B. | 放电时,负极电极反应式为:CH3OH+8OH--6e-=CO${\;}_{3}^{2-}$+6H2O | |
| C. | 标况下,通入的11.2L氧气完全反应有1mol电子转移 | |
| D. | 充电时电解质溶液的碱性逐渐减小 |