题目内容
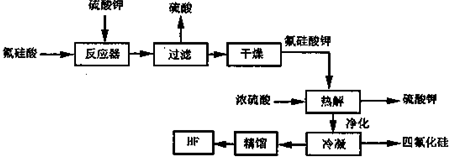
1.Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等.某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥(主要含有BaCO3、BaSO3、Ba(FeO2)2等),该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
已知:①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤.试用离子方程式说明提纯原理:BaSO4(aq)+CO32-(aq)?BaCO3(aq)+SO42-(aq)
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:Ba(FeO2)2+8HNO3 =Ba(NO3)2+2Fe(NO3)3+4H2O.
(3)该厂结合本厂实际,选用的X为D(填序号),中和I使溶液中的Fe3+、H+(填离子符号)的浓度减小
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.BaCO3
(4)最后的废渣中除原有的难溶性杂质外还含有Fe(OH)3、BaSO4(填化学式).
(5)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为$\frac{261m}{233w}$×100%.
分析 钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,过滤得到的固体洗涤后除去废渣,滤液重新加入酸溶步骤充分利用,
(1)当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化;
(2)Ba(FeO2)2与HNO3反应生成Ba(NO3)2和Fe(NO3)3,以此确定反应的化学方程式;
(3)X既要能消耗硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3,中和Ⅰ使溶液中的Fe3+形成Fe(OH)3沉淀、H+浓度减小;
(4)中和Ⅰ使溶液中H+浓度减小,Fe3+形成Fe(OH)3沉淀,硝酸具有强氧化性,将亚硫酸钡氧化为硫酸钡,故沉淀中还含有Fe(OH)3、BaSO4;
(5)根据沉淀硫酸钡的质量,结合方程式计算求出硝酸钡的质量,再求样品的纯度.
解答 解:钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,过滤得到的固体洗涤后除去废渣,滤液重新加入酸溶步骤充分利用;
(1)溶液存在BaSO4(aq)+CO32-(aq)?BaCO3(aq)+SO42-(aq),当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化,
故答案为:BaSO4(aq)+CO32-(aq)?BaCO3(aq)+SO42-(aq);
(2)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,
所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3 =Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)加入X调节溶液的pH=4~5,则X应能消耗H+,结合工厂主要生产BaCl2、BaCO3、BaSO4的实际情况,可选用BaCO3,中和后溶液中H+浓度减小,pH在4~5时,Fe3+也完全沉淀,故Fe3+浓度也减小,
故答案为:D,Fe3+、H+;
(4)Fe3+易发生水解而生成Fe(OH)3沉淀,离子方程式为Fe3++3H2O?Fe(OH)3+3 H+,加入碳酸钡,BaCO3消耗H+使Fe3+水解平衡右移,形成Fe(OH)3沉淀,硝酸具有强氧化性,将亚硫酸钡氧化为硫酸钡,故沉淀中还含有Fe(OH)3、BaSO4,
故答案为:Fe(OH)3、BaSO4;
(5)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x mg
则解得x=$\frac{261m}{233}$g,所以该Ba(NO3)2的纯度为$\frac{\frac{261m}{233}}{w}$×100%=$\frac{261m}{233w}$×100%,
故答案为:$\frac{261m}{233w}$×100%.
点评 本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,综合考查学生对新信息的处理能力、分析能力和实验能力,题目难度中等,注意把握实验原理和方法.

 阅读快车系列答案
阅读快车系列答案| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 第VIIA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 元素的最高正价数均等于该元素原子的最外层电子数 |
| A. | 充电时化学能转化为电能 | |
| B. | 放电时,负极电极反应式为:CH3OH+8OH--6e-=CO${\;}_{3}^{2-}$+6H2O | |
| C. | 标况下,通入的11.2L氧气完全反应有1mol电子转移 | |
| D. | 充电时电解质溶液的碱性逐渐减小 |
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 每一周期的元素都是从碱金属开始,以稀有气体结束 | |
| C. | 最外层电子数为2的元素都位于第ⅡA族 | |
| D. | 在已经发现的元素中,金属元素种类比非金属元素多 |
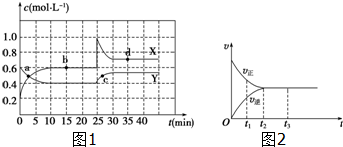
①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
| 时间(s) 物质的量(mol) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.01 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.