��Ŀ����
6����֪�������£�Ksp��AgCl��=1.8��10-10��Ksp��AgI��=8.3��10-17��������������ȷ���ǣ�������| A�� | ��AgCl������Һ�м���KI��Һ�������ɰ�ɫת��Ϊ��ɫ | |
| B�� | ��AgCl�ı�����Һ�м���KCl���壬��AgCl��������Һ��c��Ag+��=c��Cl-�� | |
| C�� | �����£�AgCl�ڱ���KCl��Һ�е�Ksp���ڴ�ˮ�е�KspС | |
| D�� | ��0.001��mol•L-1��AgNO3��Һ����NaCl��NaI�Ļ����Һ�У�һ���Ȳ���AgI���� |
���� A��������������ͬ���ܶȻ�ԽС��Խ�������ɳ�����
B����AgCl�ı�����Һ�м���NaCl���壬�ܽ�ƽ�������ƶ������ɳ�����c��Ag+����С��c��Cl-������
C��KSPֻ���¶��йأ�
D��Qc��KSP���Խ��Խ�������ɳ�����
��� �⣺A��KSP��AgCl����KSP��AgI��������ת��Ϊ�ܽ�ȸ�С����������������AgCl������Һ�м���KI��Һ�������ɰ�ɫת��Ϊ��ɫ����A��ȷ��
B����AgCl�ı�����Һ�м���NaCl���壬�ܽ�ƽ�������ƶ������ɳ�����c��Ag+����С��c��Cl-������c��Ag+����c��Cl-������B����
C��KSPֻ���¶��йأ�����Һ������Ũ���أ���C����
D��KCl��KI�Ļ����Һ�У�c��Cl-����c��I-���Ĵ�С���Ƚϣ�����QcҲ��֪�������ж�Qc��KSP����С��Ҳ����ȷ���������Ⱥ�˳��D����
��ѡA��
���� ���⿼�����ܵ���ʵ��ܽ�ƽ�⼰����ת���ı��ʣ���Ŀ�Ѷ��еȣ�ע��������������ͬʱ���ܶȻ�ԽСԽ�������ɳ�����ע�������������ܽ�ƽ�⼰��Ӱ�����أ�������ؿ���ѧ���ķ���������������

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
17�����г��ӷ�������ȷ���ǣ�������
| ���� | ���� | �Լ������ | ���� | |
| A | ������Һ | NaCl | ��Ĥ | ���� |
| B | �� | ���� | Ũ��ˮ | ���� |
| C | �Ҵ� | ˮ | ��ʯ�� | ���� |
| D | ������֬ | �Ҵ� | ����Na2C03��Һ | ��Һ |
| A�� | A | B�� | B | C�� | C | D�� | D |
14��X��Y��Z��W���ֶ�����Ԫ����Ԫ�����ڱ��е����λ����ͼ��ʾ��Z�ĵ����dz����İ뵼����ϣ��ɴ˿�֪��������
| X | ||
| Y | Z | W |
| A�� | X��Z��W�ļ��⻯����ȶ���Z��W��X | |
| B�� | WԪ�صĵ����ڻ�ѧ��Ӧ��ֻ���ֻ�ԭ�� | |
| C�� | Y��Z��W����������������NaOH��Һ��Ӧ | |
| D�� | X��Y�ļ����Ӱ뾶Y��X |
1��ijͬѧ�о������벻ͬ�ᷴӦ�IJ��죬�Լ�Ӱ�컯ѧ��Ӧ���ʵ�Ԫ�أ�
ʵ��ҩƷ��2.0mol•L-1���ᡢ4.0mol•L-1���ᡢ2.0mol•L-1���ᡢ4.0mol•L-1���ᣬ��ͬ��С����Ƭ�����ۣ���������Ĥ���ѳ�ȥ����ÿ��ʵ��������������Ϊ50.0ml������������Ϊ9.0g��
��1��������ͬѧ�������ʵ����Ʊ���
��2����ͬѧ�ڶԱ�ʵ���ʱ����ʵ���͢�ķ�Ӧ�ٶȶ����Ա�ʵ����죬���ܶ�����ԭ��������Щ�������루�г�һ�ּ��ɣ����������ӶԸ÷�Ӧ���ʵ�Ӱ�죮
ʵ��ҩƷ��2.0mol•L-1���ᡢ4.0mol•L-1���ᡢ2.0mol•L-1���ᡢ4.0mol•L-1���ᣬ��ͬ��С����Ƭ�����ۣ���������Ĥ���ѳ�ȥ����ÿ��ʵ��������������Ϊ50.0ml������������Ϊ9.0g��
��1��������ͬѧ�������ʵ����Ʊ���
| ʵ��Ŀ�� | ʵ���� | �¶� | ��������̬ | �ἰ��Ũ�� |
| 1��ʵ���͢�̽������Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�� 2��ʵ���͢�̽������ 3��ʵ���͢�̽�����������Ƭ�����ۣ��Ը÷�Ӧ���ʵ�Ӱ�� 4����ʵ��̽������ϡ�����ϡ���ᷴӦ�IJ��� | �� | 25�� | ��Ƭ | 4.0moL/L���� |
| �� | 25�� | ��Ƭ | 2.0mol•L-1���� | |
| �� | 35�� | ��Ƭ | 2.0mol•L-1���� | |
| �� | 25�� | ��Ƭ | 2.0moL/L���� | |
| �� | 25�� | ��Ƭ | 2.0mol•L-1���� |
 ��F��ԭ�ӽṹʾ��ͼΪ��
��F��ԭ�ӽṹʾ��ͼΪ��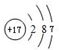 ��
��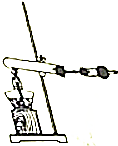 ��Ԫ���ǵ����Ϻ����ܷḻ��һ��Ԫ�أ��䵥�ʺͻ���������ǵĻ�������������Ҫ�����壮
��Ԫ���ǵ����Ϻ����ܷḻ��һ��Ԫ�أ��䵥�ʺͻ���������ǵĻ�������������Ҫ�����壮