题目内容
16.现有硫酸和硝酸的浓度分别为2mol/L和1mol/L的混合液,取混合液20mL加入足量铁粉,若硝酸的还原产物为NO,则生成一氧化氮和氢气在标准状况下的体积各为多少升?消耗的铁粉的质量为多少?分析 硫酸、硝酸的混合溶液与过量的Fe反应生成NO、氢气,说明硝酸完全被还原生成NO,最终得到FeSO4溶液,根据n=cV计算H2SO4、HNO3物质的量,根据N元素守恒可知n(NO)=n(HNO3),根据硫酸根守恒可知n(FeSO4)=n(H2SO4),根据Fe元素守恒计算参加反应Fe的物质的量,再根据电子转移守恒计算氢气物质的量,根据V=nVm计算NO、氢气体积.
解答 解:硫酸、硝酸的混合溶液与过量的Fe反应生成NO、氢气,说明硝酸完全被还原生成NO,最终得到FeSO4溶液,
根据N元素守恒可知n(NO)=n(HNO3)=0.02L×1mol/L=0.02mol,故生成NO的体积=0.02mol×22.4L/mol=0.448L;
根据硫酸根守恒可知n(FeSO4)=n(H2SO4)=0.02L×2mol/L=0.04mol,根据Fe元素守恒,参加反应Fe的物质的量=n(FeSO4)=0.04mol,令生成氢气为x mol,根据电子转移守恒:2x+0.02×(5-2)=0.04×2,解得x=0.01,故生成氢气的体积=0.01mol×22.4L/mol=0.224L;消耗铁的质量为:0.04mol×56g/mol=2.24g,
答:标况下,生成一氧化氮的体积为0.448L,生成氢气的体积为0.224L,消耗的铁粉的质量为2.24g.
点评 本题考查混合物计算,判断发生的反应是解题关键,侧重对解题方法技巧与思维能力的考查,注意利用守恒思想进行解答,难度中等.

练习册系列答案
相关题目
6.汽车尾气中NO,是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体中的血管内又有传送信息的功能,下列有关NO的说法正确的是( )
| A. | NO是一种红棕色气体,易溶于水 | |
| B. | 汽车尾气中NO的来源是空气中的N2与O2在汽车气缸内的高温环境下的反应产物 | |
| C. | 工业生产硝酸的原料主要有NO和空气 | |
| D. | 由于NO在血管中的特殊作用,所以NO无毒 |
7.铊元素位于元素周期表第6周期ⅢA族.下面关于铊元素性质的说法不正确的是( )
| A. | 氢氧化铊是两性氢氧化物 | |
| B. | 在化合物中呈+3价 | |
| C. | 单质铊与同浓度的盐酸反应比铝剧烈 | |
| D. | 铊的还原性比铝的强 |
4.下列反应的离子方程式书写正确的是( )
| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸铁溶液中加入铁:Fe3++Fe═2Fe2+ | |
| C. | 在铁上镀铜阳极反应为:Cu2++2e-═Cu | |
| D. | 氯化铜水解:Cu2++2H2O?Cu(OH)2+2H+ |
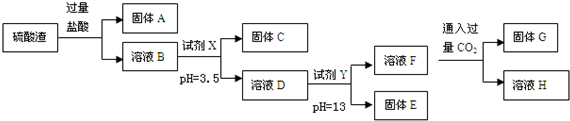
1.硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计如图实验方案,将硫酸渣中金属元素转化为氢氧化物沉淀分离开来.
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
(1)固体A的化学式为SiO2.
(2)向溶液F中通过量CO2发生反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)采用过滤操作分离固体E和溶液F,发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:漏斗液面高于滤纸的边缘、玻璃棒下端靠在滤纸的单层处,导致滤纸破损.
(4)上述流程中的试剂Y 最好选用下列的C(填字母编号)
A、氧化镁 B、氨水 C、氢氧化钾 D、氢氧化钡
(5)取w g硫酸渣(含SiO2 m g),与 c mol 盐酸恰好完全反应,则废渣中氧元素的质量分数为$\frac{8m+120c}{15w}$.(用含w、m、c的代数式表示)

已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
(2)向溶液F中通过量CO2发生反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)采用过滤操作分离固体E和溶液F,发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:漏斗液面高于滤纸的边缘、玻璃棒下端靠在滤纸的单层处,导致滤纸破损.
(4)上述流程中的试剂Y 最好选用下列的C(填字母编号)
A、氧化镁 B、氨水 C、氢氧化钾 D、氢氧化钡
(5)取w g硫酸渣(含SiO2 m g),与 c mol 盐酸恰好完全反应,则废渣中氧元素的质量分数为$\frac{8m+120c}{15w}$.(用含w、m、c的代数式表示)
8.金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能,电镀废水中六价铬具有高毒性,必须经处理后才能排放.
(1)常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①镀铬液在水溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+该反应平衡常数表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$.
②镀铬时由CrO42-放电产生铬镀层.阴极的电极反应式为CrO42-+8H++6e-=Cr+4H2O.
③ABS塑料表面经处理后也可在其表面镀铬,ABS塑料的结构简式如下:
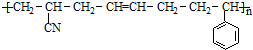 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和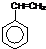 (写结构简式).
(写结构简式).
(2)工业上处理含铬废水有钡盐法、电解还原法等.
Ⅰ.钡盐法处理含铬废水主要流程为:
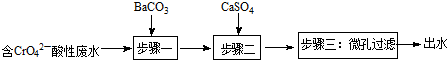
已知:
①步骤一发生的反应之一为:CrO42-+BaCO3═BaCrO4+CO32-,可推知:Ksp(BaCrO4)<Ksp(BaCO3)(选填:“>”或“<”);
②步骤二的目的是除去废水中Ba2+.
Ⅱ.电解法处理含六价铬(Cr2O72-和CrO42-)的强酸性废水,其原理如图所示.
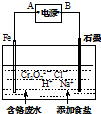
③电解一段时间后随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.图中A为电源正极(选填:“正”或“负”);
④阴极产生的气体为H2(写化学式).
⑤常温时Ksp[Cr(OH)3]=6.0×10-31,当废水的pH=7.0时,溶液中c(Cr3+)=6.0×10-10mol•L-1.
(1)常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①镀铬液在水溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+该反应平衡常数表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$.
②镀铬时由CrO42-放电产生铬镀层.阴极的电极反应式为CrO42-+8H++6e-=Cr+4H2O.
③ABS塑料表面经处理后也可在其表面镀铬,ABS塑料的结构简式如下:
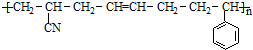 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和 (写结构简式).
(写结构简式).(2)工业上处理含铬废水有钡盐法、电解还原法等.
Ⅰ.钡盐法处理含铬废水主要流程为:

已知:
| 物质 | BaCO3 | CaSO4 | BaSO4 |
| Ksp | 8.1×10-9 | 9×10-6 | 1.1×10-10 |
②步骤二的目的是除去废水中Ba2+.
Ⅱ.电解法处理含六价铬(Cr2O72-和CrO42-)的强酸性废水,其原理如图所示.

③电解一段时间后随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.图中A为电源正极(选填:“正”或“负”);
④阴极产生的气体为H2(写化学式).
⑤常温时Ksp[Cr(OH)3]=6.0×10-31,当废水的pH=7.0时,溶液中c(Cr3+)=6.0×10-10mol•L-1.
5.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应? | |
| B. | 苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱? | |
| C. | 乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种 |
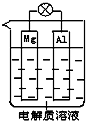 一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):
一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):