题目内容
1.下列叙述能证明某物质是弱电解质的是( )| A. | 水溶液的导电能力很弱 | |
| B. | 溶液中电离出的离子与未电离的分子共存 | |
| C. | 熔化时不导电 | |
| D. | 不是离子化合物而是共价化合物 |
分析 强弱电解质的根本区别是电解质的电离程度,完全电离的电解质是强电解质,部分电离的电解质是弱电解质,只要说明该电解质部分电离就能证明是弱电解质,据此分析解答.
解答 解:A.水溶液的导电能力与离子浓度成正比,与电解质强弱无关,所以该物质的水溶液导电能力很弱,说明该溶液中离子浓度很小,但不能说明部分电离,所以不能证明是弱电解质,故A错误;
B.溶液中电离出的离子与未电离的分子共存,说明该物质部分电离,所以能证明是弱电解质,故B正确;
C.熔化时不导电不能说明是该物质部分电离,所以不能证明是弱电解质,如共价化合物熔融状态都不导电,故C错误;
D.共价化合物也可能是强电解质,如硫酸、硝酸等,故D错误;
故选B.
点评 本题考查强弱电解质判断,为高频考点,明确强弱电解质的根本区别是解本题关键,易错选项是A,注意电解质强弱与溶液导电能力、化合物类型无关,为易错点.

练习册系列答案
相关题目
12.取代反应是有机化学中的一类重要的反应,下列过程中发生取代反应的是( )
| A. | 乙烯通入溴的四氯化碳溶液发生反应 | |
| B. | 苯与浓硝酸、浓硫酸混和后加热至50℃~60℃发生反应 | |
| C. | 在苯中滴入溴水,振荡后溴水层褪色 | |
| D. | 乙烯通入酸性高锰酸钾溶液后溶液褪色 |
9.下列离子方程式中,正确的是( )
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2-+SO42-═BaSO4↓ | |
| B. | 氧化铜与稀硫酸混合:CuO+2H+═Cu2++H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH-═Cu(OH)2↓+SO42- | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
10.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2 L水中含有分子的数目为0.5NA | |
| B. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| C. | 100 mL 0.2 mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
11.下列物质熔沸点最高的是( )
| A. | 甲烷 | B. | 正丁烷 | C. | 异丁烷 | D. | 丙烷 |
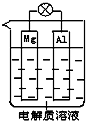 一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):
一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):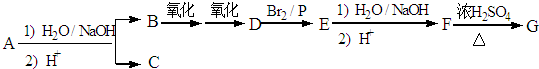
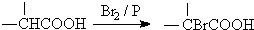
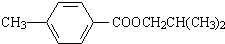 .
.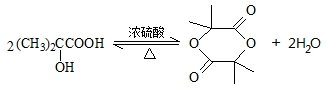 ,该反应属于酯化反应(填反应类型).
,该反应属于酯化反应(填反应类型).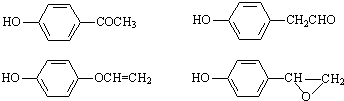 .
.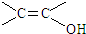 )结构.
)结构.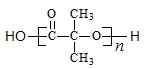 .
.