题目内容
2.下列比较正确的是( )| A. | 电离能:N>O>F | B. | 物质熔点:H2O>I2>CO2 | ||
| C. | 共价键的极性:C-F>C-O>C-N | D. | 氢化物的稳定性:HBr>HCl>HF |
分析 A.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
B.碘单质常温下为固体,水为液体;
C.形成共价键的非金属原子之间非金属性差别越大,共价键的极性越大;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,故第一电离能顺序为:F>N>O,故A错误;
B.碘单质常温下为固体,水为液体,则物质熔点:I2>H2O>CO2,故B错误;
C.形成共价键的非金属原子之间非金属性差别越大,共价键的极性越大,非金属性:F>O>N>C,则共价键的极性:C-F>C-O>C-N,故C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性:F>Cl>Br,则化物的稳定性:HF>HCl>HBr,故D错误.
故选C.
点评 本题考查元素性质的比较,把握非金属性与电负性、第一电离能的关系及熔点的比较方法为解答的关键,侧重规律性知识的考查,注意元素周期表和周期律的应用,题目难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
12.下列有关说法不正确的是( )
| A. | 相同类型的离子晶体,晶格能越大,形成的晶体越稳定 | |
| B. | NH3和H3O+是等电子体,因此结构都是三角锥形 | |
| C. | 邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在分子间氢键 | |
| D. | H3O+、HF2-和[Ag(NH3)2]+中均存在配位键 |
10.反应2S02(g)+O2?2SO3(g)△H<0,下列措施能提高S02转化率的是( )
| A. | 增大S02的浓度 | B. | 提高O2与SO2的体积比 | ||
| C. | 减小压强 | D. | 升高温度 |
7.铊元素位于元素周期表第6周期ⅢA族.下面关于铊元素性质的说法不正确的是( )
| A. | 氢氧化铊是两性氢氧化物 | |
| B. | 在化合物中呈+3价 | |
| C. | 单质铊与同浓度的盐酸反应比铝剧烈 | |
| D. | 铊的还原性比铝的强 |
14.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )
| X | ||
| Y | Z | W |
| A. | X、Z、W的简单氢化物的稳定性Z>W>X | |
| B. | W元素的单质在化学反应中只表现还原性 | |
| C. | Y、Z、W的最高价氧化物均能与NaOH溶液反应 | |
| D. | X、Y的简单离子半径Y>X |
12.取代反应是有机化学中的一类重要的反应,下列过程中发生取代反应的是( )
| A. | 乙烯通入溴的四氯化碳溶液发生反应 | |
| B. | 苯与浓硝酸、浓硫酸混和后加热至50℃~60℃发生反应 | |
| C. | 在苯中滴入溴水,振荡后溴水层褪色 | |
| D. | 乙烯通入酸性高锰酸钾溶液后溶液褪色 |
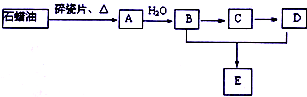 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略). ;
; ,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.
,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.