题目内容
12.金属钙线是炼制优质钢材的脱氧脱磷剂.某钙线的主要成份为金属M和Ca,并含有3.5%(质量分数)CaO.(1)Ca元素原子结构示意图为
 .
.(2)Ca与最活泼的非金属元素A形成化合物D,D的电子式为
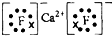 .
.(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为Fe(填化学式);检验Mn+的方法是取少量含Mn+的溶液,加入硫氰化钾,显血红色,则证明含Mn+.
分析 (1)根据原子核外电子排布画出原子结构示意图;
(2)先判断最活泼的非金属元素,再确定该化合物的化学式,根据电子式书写规则写出电子式;
(3)生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,应为Fe(OH)2→Fe(OH)3的转化,M为Fe元素,检验铁离子常用SCN-,根据Fe3+与SCN-反应的现象分析.
解答 解:(1)Ca是20号元素,元素的原子序数=其核外电子数=核内质子数,其核外电子排布是2,8,8,2,所以其原子结构示意图为 ,
,
故答案为 ;
;
(2)元素周期表中最活泼的非金属元素是F元素,与Ca形成化合物离子化合物D,所以D是CaF 2,其电子式为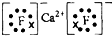 ,
,
故答案为: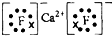 ;
;
(3)生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,应为Fe(OH)2→Fe(OH)3的转化,钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀,FeCl2+2NaOH=Fe(OH)2↓+2NaCl,并迅速变成灰绿色,最后变成红褐色M(OH)n,4Fe(OH)2+O2+2H2O=4Fe(OH)3,M为Fe元素,检验铁离子常用SCN-,Fe3+与SCN-结合生成血红色物质Fe(SCN)3,离子方程式为Fe3++3SCN-?Fe(SCN)3,检验Fe3+的方法是取少量含Fe3+的溶液,加入硫氰化钾,显血红色,则证明含Fe3+,
故答案为:Fe;加入硫氰化钾,显血红色.
点评 本题考查结构与位置关系、常用化学用语书写、离子的检验等,掌握基础是关键,注意铁离子的检验方法以及Fe(OH)2→Fe(OH)3的转化特征,题目难度不大.

练习册系列答案
相关题目
2.下列各组物质的晶体,化学键类型相同,晶体类型也相同的是( )
| A. | SO2和SiO2 | B. | CO2 和NaCl | C. | NH4Cl 和HCl | D. | H2O2和C3H6 |
3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氮原子的氮气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数小于3NA | |
| C. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 |
20.下列溶液混合后,pH值最大的是( )
| A. | 0.1mol/LH2SO4与0.2mol/L 氨水各50mL | |
| B. | 0.1mol/LCH3COOH与0.1mol/LNaOH 溶液各50mL | |
| C. | pH=1的CH3COOH与pH=13的 NaOH 溶液各50mL | |
| D. | pH=1的盐酸与 pH=13的 NaOH 溶液各50mL |
4.在标准状况下,将7g N2、11g CO2和16g SO2混合,该混合气体的体积约是( )
| A. | 5.6L | B. | 11.2L | C. | 16.8L | D. | 22.4L |
 ;
;
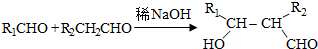
 .
. .
.
 (写结构简式)
(写结构简式)