题目内容
13.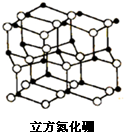 氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).
氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).(1)电负性大小:硼原子小于氮原子;第一电离能:氮原子大于氧原子(填大于、小于或等于).
(2)氮化硼的化学式为:BN.
(3)预测立方氮化硼的晶体类型为原子晶体,晶体内的作用力是共价键,氮原子的杂化类型为sp3.
(4)立方氮化硼具有广泛的应用前景,其合成方法多样.其中水溶剂热合成法是在一定条件下溴化硼和氮化锂反应,再分离、洗涤、干燥得到氮化硼.
①溴化硼为共价 化合物(填“离子”或“共价”),其空间构型为平面三角形.
②请写出上述方法生成氮化硼的化学方程式:BBr3+Li3N═3LiBr+BN.
分析 (1)同一周期元素,元素的电负性随着原子序数增大而增大;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(2)该晶体中含有43.6%的硼和56.4%的氮,则B、N原子个数之比=$\frac{43.6%}{11}$:$\frac{56.4%}{14}$=1:1,所以化学式为BN;
(3)原子晶体的构成微粒是原子,根据晶体构成微粒判断晶体类型;原子晶体中原子之间存在共价键;每个N原子和4个B原子,所以其价层电子对个数是4;
(4)①非金属性元素之间易形成共价键,只含共价键的化合物是共价化合物;溴化硼中B元素价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断空间构型;
②根据反应物、生成物书写方程式.
解答 解:(1)同一周期元素,元素的电负性随着原子序数增大而增大,所以电负性B<N;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,第一电离能N>O,
故答案为:小于;大于;
(2)该晶体中含有43.6%的硼和56.4%的氮,则B、N原子个数之比=$\frac{43.6%}{11}$:$\frac{56.4%}{14}$=1:1,所以化学式为BN,
故答案为:BN;
(3)原子晶体的构成微粒是原子,根据晶体构成微粒知晶体类型是原子晶体;原子晶体中原子之间存在共价键,所以该晶体中存在共价键;每个N原子和4个B原子,所以其价层电子对个数是4,则N原子杂化方式为sp3,
故答案为:原子晶体;共价键;sp3;
(4)①非金属性元素之间易形成共价键,只含共价键的化合物是共价化合物,该物质中只含共价键,所以是共价化合物;溴化硼中B元素价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知,空间构型是平面三角形,故答案为:共价;平面三角形;
②根据反应物、生成物书写方程式为BBr3+Li3N═3LiBr+BN,故答案为:BBr3+Li3N═3LiBr+BN.
点评 本题考查物质结构和性质,为高频考点,涉及原子杂化方式判断、微粒空间构型判断、化学式判断及晶体类型判断等知识点,利用价层电子对互斥理论、均摊法等知识点分析解答即可,难点是孤电子对的计算方法,题目难度不大.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 金刚石的晶胞中含有4个碳原子 | |
| D. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
| A. | H2O和H2O2 | B. | 12C和14C | C. | O2和O3 | D. | SO2和SO3 |
| A. | 氯气与氢氧化钠溶液:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O |
| A. | 常温常压下,18g(H218O)含有的原子总数为3NA | |
| B. | 标准状况下,4.2g CH2=CH2气体中所含有的碳原子总数为0.3NA | |
| C. | 将0.1mol的Cl2通入1L水中转移的电子数目为0.1NA | |
| D. | 0.1mol/LAl2(SO4)3溶液中含有的Al3+总数为0.2NA |
| A. | 晶格能大小:NaI>NaBr>NaCl>NaF | B. | 单质的熔点:Li<Na<K<Rb | ||
| C. | 共价键的键能:C-C>C-Si>Si-Si | D. | 沸点高低:HF<HCl<HBr<HI |