题目内容
18.下列化学反应的离子方程式正确的是( )| A. | 氯气与氢氧化钠溶液:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O |
分析 A.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
B.电荷不守恒;
C.向亚硫酸钠溶液中加入足量硝酸,发生氧化还原反应,亚硫酸根离子被氧化生成硫酸根离子;
D.二氧化碳过量反应生成碳酸氢钙.
解答 解:A.氯气与氢氧化钠溶液,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,故A正确;
B.将少量金属钠放人冷水中,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.酸性条件下,亚硫酸钠被硝酸氧化生成硫酸钠,离子反应方程式为:3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O,故C错误;
D.向澄清石灰水中通入过量二氧化碳,离子方程式:HCO3-+H+=CO2↑+H2O,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,选项D为易错选项.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1mol Na2O2与水反应转移电子数目为0.1NA | |
| B. | 标况下,2.24L Cl2含孤电子对的数目为0.2NA | |
| C. | pH=2的H2SO4溶液中含H+的数目为0.1NA | |
| D. | 在10g质量分数为17%的氨水中,含有H的数目为0.3NA |
3.禁止用工业酒精配制饮用酒,这是因为酒精中含有的少量有毒物质是( )
| A. | 甘油 | B. | 醋酸 | C. | 甲醇 | D. | 乙醛 |
10.密闭容器中发生可逆反应:X2(g)+Y2(g)?2Z(g).已知起始时X2、Y2、Z各物质的浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,反应在一定条件下达到平衡时,各物质的物质的量浓度不可能是( )
| A. | c(Z)=0.3 mol•L-1 | B. | c(Y2)=0.35 mol•L-1 | ||
| C. | c(X2)=0.15 mol•L-1 | D. | c(Z)=0.4 mol•L-1 |
7.下列说法错误的是( )
| A. | 实验室制快速氨气可用浓氨水滴加到固体NaOH中 | |
| B. | 漂白粉的成分是NaCl与NaClO | |
| C. | 水玻璃应保存在具橡皮塞的玻璃试剂瓶中 | |
| D. | NO气体的收集不能用排空气法 |
8.在气相中,关于BeF2和SF2的说法错误的是( )
| A. | BeF2分子中,中心原子Be的价层电子对数等于2,其空间排布为直线,成键电子对数也等于2 | |
| B. | BeF2分子的立体结构为直线形 | |
| C. | SF2分子中,中心原子S的价层电子对数等于4,其空间排布为四面体,成键电子对数等于2,没有孤对电子 | |
| D. | 在气相中,BeF2是直线形而SF2是V形 |

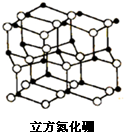 氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).
氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).