题目内容
4.有一白色固体混合物,可能含有K+、Ba2+、Ag+、Mg2+、NH4+、Na+、SO42-、SO32-、CO32-、AlO2- 等10种离子中的几种.为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列空格:(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12.据此可以排除的离子有Ag+、Mg2+、NH4+,排除的依据是由于溶液呈碱性,故可排除Ag、Mg2+,又未嗅到刺激性气味,故无NH4+.
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出.可以判断肯定存在的离子有AlO2-、CO32-,判断依据是因为加酸有沉淀,继续加酸沉淀溶解,故含有AlO2-,同时有无色无味气体逸出,故含有CO32-;可以排除的离子有Ba2+、SO32-,排除的依据是因为存在CO32-,故不存在Ba2+,酸化后逸出气体没有刺激性气味,故不含SO32-.
(3)不能确定的离子有K+、Na+、SO42-,检验的方法是检验K+和Na+用焰色反应,要检验SO42-,可在酸性溶液中滴加BaCl2溶液,是否有白色沉淀生成.
分析 (1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,溶液呈碱性,溶液中一定不存在Ag+、Mg2+、NH4+;
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,说明含有AlO2-,同时有无色无味气体逸出,结合阴离子分析只有碳酸根离子符合,依据离子共存判断一定不含有Ba2+、SO32-;碳酸根离子和钡离子结合生成白色沉淀,亚硫酸根离子和盐酸反应生成无色有刺激性气味的气体二氧化硫;
(3)依据分析可知阳离子K+、Na+,不能确定,利用焰色反应进行验证.
解答 解:(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,溶液呈碱性,溶液中一定不存在Ag+、Mg2+、NH4+,
故答案为:Ag+、Mg2+、NH4+;由于溶液呈碱性,故可排除Ag、Mg2+,又未嗅到刺激性气味,故无NH4+;
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,说明含有AlO2-,同时有无色无味气体逸出,结合阴离子分析只有碳酸根离子符合,依据离子共存判断一定不含有Ba2+、SO32-;碳酸根离子和钡离子结合生成白色沉淀,亚硫酸根离子和盐酸反应生成无色有刺激性气味的气体二氧化硫,
故答案为:AlO2-、CO32-;因为加酸有沉淀,继续加酸沉淀溶解,故含有AlO2-,同时有无色无味气体逸出,故含有CO32-; Ba2+、SO32-;因为存在CO32-,故不存在Ba2+,酸化后逸出气体没有刺激性气味,故不含SO32-;
(3)依据分析可知K+、Na+、SO42-不能确定,利用焰色反应进行验证,利用焰色反应,用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧出现黄色火焰,说明一定含有钠离子,隔着钴玻璃观察出现紫色火焰证明含有钾离子,无紫色证明无钾离子;用盐酸酸化的氯化钡溶液检验硫酸根离子,
故答案为:K+、Na+、SO42-;检验K+和Na+用焰色反应,要检验SO42-,可在酸性溶液中滴加BaCl2溶液,是否有白色沉淀生成.
点评 本题考查了离子检验的检验方法、离子共存的应用,题目难度中等,明确离子性质及检验方法是解题关键,注意检验离子存在时,必须排除干扰离子,确保检验方案的严密性.

| A. | 在相同温度下,甲酸溶液比盐酸溶液的导电性弱 | |
| B. | 甲酸能与NaHCO3作用放出CO2气体 | |
| C. | 等体积、等物质的量浓度甲酸溶液与NaOH溶液混合时恰好完全中和 | |
| D. | 室温下,1mol/L的甲酸溶液的pH=2 |
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH4++2Ag↓+3NH3+H2O |
| A. | 乙烯的最简式C2H4 | B. | 金刚石的结构模型: | ||
| C. | 溴化钠的电子式: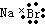 | D. | 臭氧的分子式O3 |
| 实验编号 | 1 | 2 | 3 | 4 |
| c(CH3COCH3)/mol•L-1 | 2.500 | 2.500 | 1.250 | 2.500 |
| c(HCl)/mol•L-1 | 0.500 | 1.000 | 1.000 | 1.000 |
| c(I2)/mol•L-1 | 0.010 | 0.010 | 0.010 | 0.020 |
| v(I2)/10-6 mol•L-1•s-1 | 1.500 | 3.000 | 1.498 | 3.000 |
| A. | I2的起始浓度越大,反应速率越大 | |
| B. | 该反应中HCl是催化剂,c(HCl)的改变不会影响反应速率 | |
| C. | 实验2与实验4两组实验的实验时间相等 | |
| D. | v(I2)/[c(CH3COCH3)•c(HCl)]为常数 |
 甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:
甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置: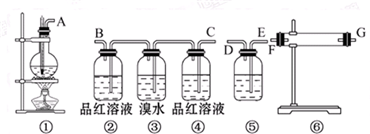
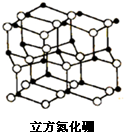 氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).
氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).