题目内容
5.写出下列反应方程式(1)CH2=CH2+H2→CH3CH3;
(2)CH2=CH2+HCl→CH3-CH2Cl;
(3)CH≡CH+HCl→CH2=CHCl;
(4)CH3CH2OH+Na→2CH3CH2ONa+H2↑;
(5)CH4+O2→CO2+2H2O.
分析 (1)乙烯与氢气反应生成乙烷;
(2)乙烯与氯化氢发生加成反应生成氯乙烷;
(3)乙炔与氯化氢1:1加成生成氯乙烯;
(4)乙醇与钠反应生成乙醇钠和氢气;
(5)甲烷燃烧生成二氧化碳和水.
解答 解:(1)乙烯与氢气反应生成乙烷,方程式:CH2=CH2+H2→CH3CH3,
故答案为:CH3CH3;
(2)乙烯与氯化氢发生加成反应生成氯乙烷,方程式:CH2=CH2+HCl→CH3-CH2Cl;
故答案为:CH3-CH2Cl;
(3)乙炔与氯化氢1:1加成生成氯乙烯,方程式:CH≡CH+HCl→CH2=CHCl;
故答案为:CH2=CHCl;
(4)乙醇与钠反应生成乙醇钠和氢气,方程式:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
故答案为:2CH3CH2ONa+H2↑;
(5)甲烷燃烧生成二氧化碳和水,方程式:CH4+2O2→CO2+2H2O;
故答案为:CO2+2H2O.
点评 本题考查了有机化学反应方程式的书写,侧重考查烯烃、炔烃的加成反应,明确加成反应的原理是解题关键,题目难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
15.下列事实能证明甲酸是弱酸的是( )
| A. | 在相同温度下,甲酸溶液比盐酸溶液的导电性弱 | |
| B. | 甲酸能与NaHCO3作用放出CO2气体 | |
| C. | 等体积、等物质的量浓度甲酸溶液与NaOH溶液混合时恰好完全中和 | |
| D. | 室温下,1mol/L的甲酸溶液的pH=2 |
16.下列有关化学用语正确的是( )
| A. | 乙烯的最简式C2H4 | B. | 金刚石的结构模型: | ||
| C. | 溴化钠的电子式: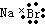 | D. | 臭氧的分子式O3 |
20.下列各组有机物中,仅使用溴水不能鉴别出来的是( )
| A. | 苯 四氯化碳 | B. | 乙炔 乙烯 | C. | 乙烷 乙烯 | D. | 苯 酒精 |
10.密闭容器中发生可逆反应:X2(g)+Y2(g)?2Z(g).已知起始时X2、Y2、Z各物质的浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,反应在一定条件下达到平衡时,各物质的物质的量浓度不可能是( )
| A. | c(Z)=0.3 mol•L-1 | B. | c(Y2)=0.35 mol•L-1 | ||
| C. | c(X2)=0.15 mol•L-1 | D. | c(Z)=0.4 mol•L-1 |
14.某探究小组利用反应CH3COCH3+I2$\frac{\underline{\;HCl\;}}{\;}$CH3COCH2I+HI,研究反应物浓度与反应速率的关系,通过测定I2颜色消失所需的时间来确定v(I2).在一定温度下,测得反应物不同起始浓度下的v(I2)如表:
下列说法正确的是( )
| 实验编号 | 1 | 2 | 3 | 4 |
| c(CH3COCH3)/mol•L-1 | 2.500 | 2.500 | 1.250 | 2.500 |
| c(HCl)/mol•L-1 | 0.500 | 1.000 | 1.000 | 1.000 |
| c(I2)/mol•L-1 | 0.010 | 0.010 | 0.010 | 0.020 |
| v(I2)/10-6 mol•L-1•s-1 | 1.500 | 3.000 | 1.498 | 3.000 |
| A. | I2的起始浓度越大,反应速率越大 | |
| B. | 该反应中HCl是催化剂,c(HCl)的改变不会影响反应速率 | |
| C. | 实验2与实验4两组实验的实验时间相等 | |
| D. | v(I2)/[c(CH3COCH3)•c(HCl)]为常数 |
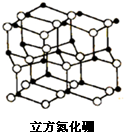 氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).
氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).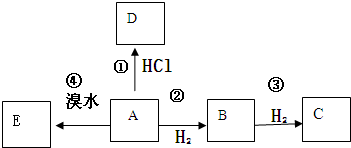
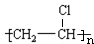 .
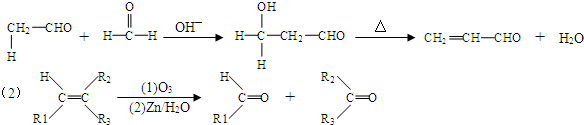
.
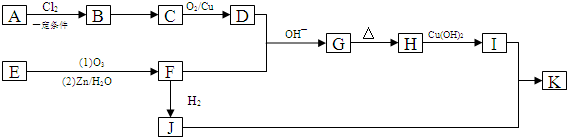
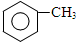 ,B→C的反应类型为:取代反应
,B→C的反应类型为:取代反应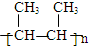
 +O2$→_{△}^{Cu}$ 2
+O2$→_{△}^{Cu}$ 2 +H2O;I+J→K:
+H2O;I+J→K: +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$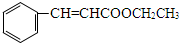 +H2O
+H2O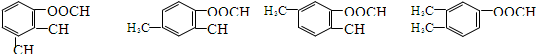 .
.