题目内容
3.下列叙述中正确的是( )| A. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 金刚石的晶胞中含有4个碳原子 | |
| D. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
分析 A.二氧化硅晶体中每个硅原子和四个O原子以共价键相结合;
B.金属晶体的熔沸点不一定比分子晶体的高;
C.金刚石晶胞结构为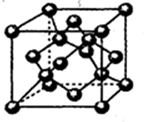 ,晶胞中C原子个数=4+6×$\frac{1}{2}$+8×$\frac{1}{8}$;
,晶胞中C原子个数=4+6×$\frac{1}{2}$+8×$\frac{1}{8}$;
D.NaCl晶胞结构为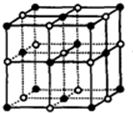 ,晶体中与每个Na+距离相等且最近的Na+个数=3×8÷2.
,晶体中与每个Na+距离相等且最近的Na+个数=3×8÷2.
解答 解:A.二氧化硅晶体中每个硅原子和四个O原子以共价键相结合生成正四面体结构,故A错误;
B.金属晶体的熔沸点不一定比分子晶体的高,如S单质的熔沸点高于Hg,故B错误;
C.金刚石晶胞结构为 ,晶胞中C原子个数=4+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,故C错误;
,晶胞中C原子个数=4+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,故C错误;
D.NaCl晶胞结构为 ,NaCl晶体中与每个Na+距离相等且最近的Na+个数=3×8÷2=12,故D正确;
,NaCl晶体中与每个Na+距离相等且最近的Na+个数=3×8÷2=12,故D正确;
故选D.
点评 本题考查不同晶体结构及其计算,为高频考点,侧重考查学生空间想象能力及计算能力,熟练掌握金刚石、氯化钠、氯化铯等晶胞结构,难点是计算配位数,易错选项是B.

练习册系列答案
相关题目
20.下列物质分类正确的是( )
| A. | 非电解质:NH3 | B. | 氧化物:H2C2O4 | ||
| C. | 混合物:KAl(SO4)2•12H2O | D. | 强酸:HClO |
11.反应2SO2+O2?2SO3达到平衡后,再向反应容器中充入含氧的同位素的氧气,经过一段时间后,原子存在于( )
| A. | O2 | B. | SO2 | C. | O2和SO2 | D. | O2、SO2和SO3 |
18.太阳能的开发和利用是21世纪一个重要课题.利用储能介质储存太阳能的原理是:白天在太阳照射下某种盐熔化,吸收热量,晚间熔盐固化释放出相应的能量,已知数据:
其中最适宜选用作为储能介质的是( )
| 盐 | 熔点(℃) | 熔化吸热(kJ•mol-1) | 参考价格(元•t-1) |
| CaCl2•6H2O | 29.9 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 35.1 | 100.1 | 1 600~2 000 |
| Na2S2O3•5H2O | 45.0 | 49.7 | 1 400~1 800 |
| A. | CaCl2•6H2O | B. | Na2SO4•10H2O | C. | Na2HPO4•12H2O | D. | Na2S2O3•5H2O |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1mol Na2O2与水反应转移电子数目为0.1NA | |
| B. | 标况下,2.24L Cl2含孤电子对的数目为0.2NA | |
| C. | pH=2的H2SO4溶液中含H+的数目为0.1NA | |
| D. | 在10g质量分数为17%的氨水中,含有H的数目为0.3NA |
15.下列事实能证明甲酸是弱酸的是( )
| A. | 在相同温度下,甲酸溶液比盐酸溶液的导电性弱 | |
| B. | 甲酸能与NaHCO3作用放出CO2气体 | |
| C. | 等体积、等物质的量浓度甲酸溶液与NaOH溶液混合时恰好完全中和 | |
| D. | 室温下,1mol/L的甲酸溶液的pH=2 |
12.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH4++2Ag↓+3NH3+H2O |
 甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:
甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置: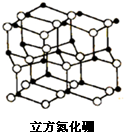 氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).
氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不同的变体,立方氮化硼是其中一种.立方氮化硼的硬度仅次于金刚石而远远高于其它材料,常用作磨料和刀具材料,其结构与金刚石类似(如图).